Применение алгоритма комплексного ультразвукового исследования сосудистой системы головного мозга при гипертонической энцефалопатии
Рубрика: Функциональная диагностика

Журнал "SonoAce Ultrasound"
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Введение
В настоящее время одними из наиболее приоритетных направлений современной ангионеврологии являются профилактика, ранняя диагностика и лечение сосудистых заболеваний головного мозга в том числе их хронических форм в виде дисциркуляторной энцефалопатии [1-4]. Ведущим фактором риска развития и прогрессирования дисциркуляторной энцефалопатии считается артериальная гипертония [1, 3, 5]. Наиболее перспективными, безопасными и доступными для оценки состояния сосудистого русла при артериальной гипертонии являются ультразвуковые (УЗ) методики [6-13]. Как правило, наиболее глубоко изучается при дисциркуляторной энцефалопатии состояние магистральных артерий головы, в то время как морфометрические исследования головного мозга показали, что примерно 85% объема сосудистого русла мозга приходится на венозные сосуды, 10% - на артерии и 5% - на капилляры [14]. Ю.М. Никитин [10] предложил упорядочить систему применения ультразвука на фоне развернутого структурирования всей системы кровоснабжения сосудистой системы головного мозга. Представлен алгоритм комплексного УЗ-исследования сосудистой системы головного мозга на основе концепции ее построения на пяти функционально-морфологических уровнях: первый - магистральные артерии головы, второй - экстра- и интрацеребральные артерии, третий - микроциркуляторное русло, четвертый - венозная система головы (венулы, малые вены, венозные сплетения, синусы), пятый - яремные, позвоночные вены, шейные венозные сплетения, верхняя полая вена. При артериальной гипертонии наблюдаются изменения сосудов на всех структурно-функциональных уровнях единой сосудистой системы головного мозга. При этом в ряде случаев необходимо учитывать конституциональный и наследственный факторы.
Материал и методы
209 больных гипертонической энцефалопатией (ГЭ) I-III ст. в возрасте от 37 лет до 71 года (средний возраст 52±10,7 года) были разделены на группы: с конституциональной флебопатией (КФП) - 93 (44,5%) человека и без конституциональной флебопатии (НФ) - 116 (55,5%) человек. Критериями включения в группу с КФП являлись наличие жалоб, обусловленных венозной церебральной дисциркуляцией, наличие нескольких типичных локализаций венозной патологии (варикозное расширение и тромбоз вен нижних конечностей, геморрой, варикоцеле, варикозное расширение вен пищевода), семейный "венозный" анамнез [11]. Критериями исключения явилось наличие соматических заболеваний, сопровождающихся вторичными нарушениями венозного кровообращения. Группу контроля (ГК) составили 30 человек.
Исследование сосудов шеи (артерий и вен) проводили методом цветового дуплексного сканирования в положении пациента лежа на спине после 10-минутного отдыха на современном ультразвуковом приборе линейными датчиками 5-12 МГц по алгоритму Ю.М. Никитина [10]. Оценивали структурное состояние сосудов, линейную скорость кровотока (ЛСК): максимальную (Vmax), минимальную (Vmin), усредненную по времени (Vmed), а также объемный кровоток (Vvol med, Vvol max, Vvol min) и индекс резистентности (IR).
Исследование интракраниальных сосудов проводилось методом транскраниального цветового дуплексного сканирования линейными и фазированными датчиками 2,1-2,5 МГц. Оценивали ЛСК и IR.
Первый функционально-морфологический уровень включал общие сонные артерии (ОСА), внутренние сонные артерии (ВСА), позвоночные артерии (ПА).
Оценка состояния сосудов второго функционально-морфологического уровня включала исследование кровотока по средней мозговой артерии (СМА), так как этот сосуд приносит 75% крови к полушариям мозга.
Для исследования сосудов третьего функционально-морфологического уровня - микроциркуляторного русла - оценивали цереброваскулярный резерв (ЦВР), поскольку прямое обследование мелких артерий и капилляров технически невозможно, а данный показатель непосредственно связан с их поражениями [10]. ЦВР, или гемодинамический резерв, мозга определяется уровнем реактивности мозговых сосудов [7, 9]. Для изучения реактивности вен Розенталя (ВР) выполняли пробу с сублингвальным введением 0,25 мг нитроглицерина. Динамическая оценка показателей кровотока осуществлялась на 1, 2, 3, 4, 5-й минутах после введения препарата.
Четвертый морфофункциональный уровень включал вены основания мозга, прямой синус (ПС). Исследование проводилось в положении лежа и в ортостазе.
Пятый морфофункциональный уровень включал внутренние яремные вены (ВЯВ), позвоночные вены (ПВ). Проводилась проба Вальсальвы.
Перед началом исследования всем больным выполнялась проба с отведением верхних конечностей для исключения синдрома компрессии сосудисто-нервного пучка при выходе из грудной клетки [13]. Для лучшей визуализации и устранения давления на сосуды применяли методику создания "гелевой подушки".
Все случаи гипертонической энцефалопатии были подтверждены магнитно-резонансной томографией, выполненной на аппаратах с напряженностью магнитного поля 1,5 Тл. В сосудистом режиме оценивали верхний сагиттальный, прямой, поперечные венозные синусы головного мозга, поверхностные вены мозга, большую мозговую вену, ВЯВ.
Статистическая обработка результатов проводилась с использованием прикладных программ Statistica 6.0 и Excel, с вычислением критерия достоверности (р), средней арифметической (M), стандартного отклонения (SD), результаты представлены в виде М (SD). За достоверные принимались различия при р<0,05.
Результаты
Изменения при артериальной гипертонии сосудов первого уровня сосудистой системы головного мозга приводят к их деформации и формированию в них септальных стенозов [8, 15]. В ходе работы выявлены извитость ОСА в 42,1% случаев и ПА в 34,9%, а также нарастание частоты их атеросклеротических поражений (37% - в I ст. ГЭ, 96,3% - в III ст. ГЭ; p<0,05), одинаково часто у лиц с конституциональной венозной недостаточностью и без нее. Наряду с этим в сосудах первого уровня установлено снижение ЛСК (рис. 1).
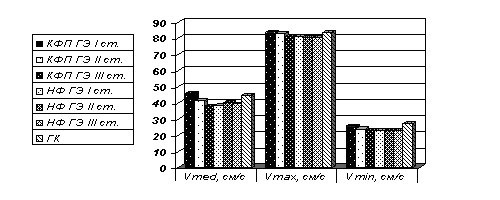
Рис. 1. Показатели ЛСК по ОСА в группах больных в зависимости от наличия конституциональной венозной недостаточности.
В группе с КФП снижение ЛСК по ОСА по сравнению с ГК установлено во II ст. ГЭ, в группе НФ - уже в I ст. ГЭ.
Выявлено снижение ЛСК по ВСА, начиная со II ст., повышение периферического сосудистого сопротивления (рис. 2). Изменения одинаковой степени были обнаружены в группах с КФП и НФ.
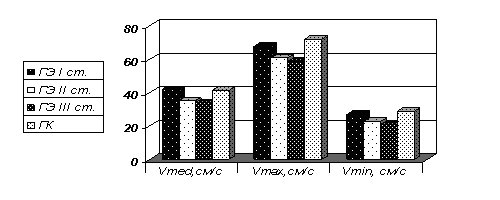
Рис. 2. Показатели ЛСК по ВСА. Темпы депрессии ЛСК по ПА были сопоставимы с таковыми по ОСА.
При исследовании сосудов второго функционального уровня установлено повышение IR СМА в III ст. ГЭ [0,86 (0,18)] по сравнению с ГК [0,82 (0,15); p<0,05] независимо от наличия конституциональной венозной недостаточности. ЛСК по СМА снижалась во всех группах уже в I ст. ГЭ.
При исследовании сосудов третьего функционального уровня в группе контроля с 1-й минуты наблюдения после приема нитроглицерина было отмечено повышение ЛСК по ВР [с 11,2 (2,5) до 13,2 (2,3) см/с; p<0,03] и IR [с 0,47 (0,06) до 0,48 (0,10); p<0,05] по сравнению с фоновыми значениями. В группе НФ регистрировали снижение ЛСК [с 12,4 (3,4) до 8,9 (3,1) см/с; p<0,05] и IR [с 0,42 (0,1) до 0,35 (0,12); p<0,05]. В группе с КФП наблюдали снижение только ЛСК [с 13,4 (5,7) до 8,6 (2,1) см/с; p<0,05].
Исследование четвертого структурно-функционального уровня сосудистой системы головного мозга включало оценку гемодинамики по прямому синусу (ПС).
При исследовании ПС в положении лежа в покое в группе с КФП определены статистически значимо более высокие по сравнению с ГК показатели кровотока (рис. 3).
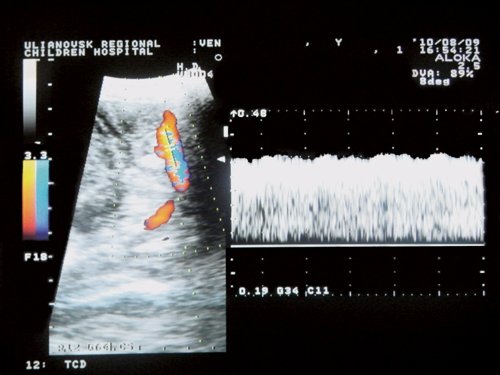
Рис. 3. Кровоток по прямому синусу у больного с конституциональной флебопатией.
У НФ эти показатели были сопоставимы с таковыми в ГК (рис. 4).
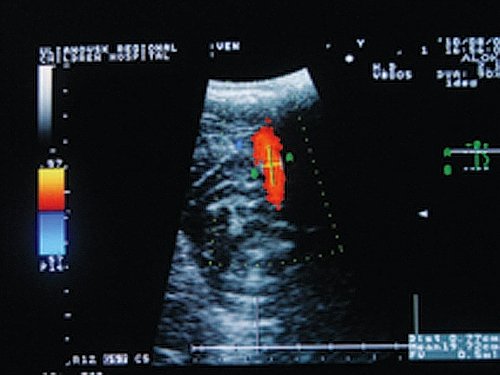
Рис. 4. Кровоток по прямому синусу у больного без конституциональной флебопатии.
При проведении пробы Вальсальвы наблюдались разнонаправленные реакции: в ГК скоростные показатели возрастали, у больных ГЭ (с КФП и у НФ) скоростные показатели снижались.
Оценка гемодинамики на пятом уровне показала увеличение площади просвета ВЯВ у больных ГЭ [1,07 (0,81) см2] по сравнению с контролем [0,82 (0,29) см2; p<0,05]. В то же время у 23 (24,7%) больных с конституциональной флебопатией были выявлены гипоплазированные и малые вены (рис. 5).
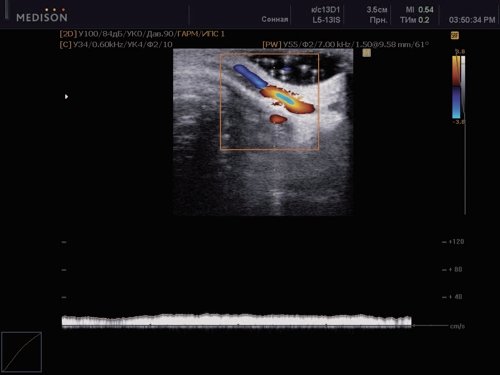
Рис. 5. Гипоплазия внутренней яремной вены у больного с конституциональной венозной недостаточностью.
Обязательным условием нормальной венозной гемодинамики является сохранность функции клапанного аппарата ВЯВ [11-13, 16]. По нашим наблюдениям, при исследовании в горизонтальном положении у 100% больных с КФП была выявлена клапанная недостаточность вен различной этиологии: у 55 (67,9%) - врожденные аномалии клапанов, их недоразвитие либо отсутствие, у 7 (8,6%) - тромбозы, у 19 (23,5%) - вторичная клапанная недостаточность в результате расширения ВЯВ. У 8 (9,9%) пациентов клапанная недостаточность сочеталась со сдавлением ВЯВ извитыми ОСА. У 72,8% больных с КФП недостаточность остальных клапанов ВЯВ была гемодинамически значимой: сопровождалась подклапанной регургитацией и ретроградным забросом крови, усиливавшимся при пробе Вальсальвы. У 27,2% обследованных регургитация возникала только при проведении пробы Вальсальвы, что указывает на клапанную недостаточность функционального характера (рис. 6, 7).
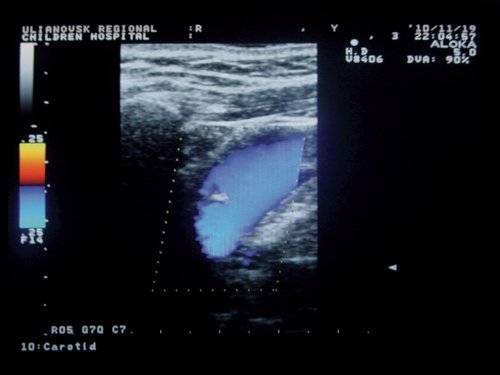
Рис. 6. Кровоток по внутренней яремной вене у больного с конституциональной венозной недостаточностью в покое.
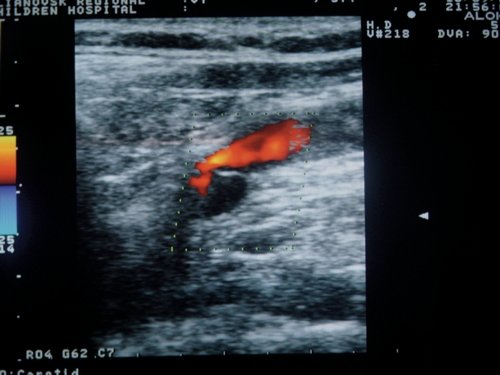
Рис. 7. Кровоток по внутренней яремной вене у больного с конституциональной венозной недостаточностью при проведении пробы Вальсальвы.
При исследовании в положении сидя проявления клапанной недостаточности нивелировались. В данной группе установлены также повышение сосудистого сопротивления во II ст. [0,85 (0,28)] и III ст. [0,79 (0,27)] ГЭ по сравнению с ГК [0,78 (0,12); p<0,05], снижение Vmed [15,9 (22,4) см/с] и Vmin [8,0 (3,9) см/с] в III ст. ГЭ по сравнению с ГК [25,7 (17,0) и 11,2 (3,5) см/с; p<0,05], Vmax во II ст. [38,1 (21,1) см/с] и III ст. [31,0 (21,2) см/с] ГЭ по сравнению с ГК [42,0 (23,5) см/с; p<0,05], повышение Vvol max во II ст. [569,0 (101,4) мл/мин] и III ст. [538,0 (102,3) мл/мин] ГЭ по сравнению с ГК [424,0 (104,3) мл/мин; p<0,05]. Проведенный корреляционный анализ не выявил взаимосвязей между фоновыми показателями гемодинамики по ВЯВ и ПС ни в одной группе. Однако при проведении пробы Вальсальвы наблюдались описанные выше изменения гемодинамических параметров по ПС.
У всех пациентов данной группы при обследовании в горизонтальном положении функционировали ПВ, объемный кровоток по ним был увеличен [Vvol med 18,4 (17,7) мл/мин, Vvol max 22,7 (2,4) мл/мин, Vvol min 8,8 (1,9) мл/мин] по сравнению с контролем [Vvol med 6,4 (1,5) мл/мин, Vvol max 12,3 (2,2) мл/мин, Vvol min 4,4 (1,3) мл/мин; p<0,05]. Однако нами не было выявлено взаимосвязей между увеличением скорости кровотока по ПВ и гемодинамическими параметрами в интракраниальных венозных сосудах, что сопоставимо с данными литературы [17].
В группе НФ по сравнению с ГК установлены расширение ВЯВ в области нижней луковицы [1,18 (0,80) см2; p<0,05] и увеличение сосудистого сопротивления [1,18 (0,80); p<0,05] в III ст. ГЭ; отсутствовали изменения линейных и объемных параметров кровотока. Гемодинамические параметры по ПВ у больных данной группы были сопоставимы с контрольными.
На МРТ были определены признаки поражения белого вещества головного мозга и ликворопроводящей системы с характерной триадой признаков: расширение желудочковой системы и субарахноидальных ликворных пространств, наличие зон перивентрикулярной гиперинтенсивности и мелких гиперинтенсивных очагов в белом веществе головного мозга. По мере утяжеления стадии ГЭ наблюдалось статистически значимое увеличение линейных размеров [с 2,1 (0,29) до 3,5 (0,34) см; p<0,05] и индекса тел [с 12,9 (2,1) до 24,9 (3,8); p<0,03] боковых желудочков, числа больных с очаговыми изменениями мозга (с 34,3 до 71,2%; p<0,01) и лейкоареозом (с 5,7 до 48%; p<0,05). Такая же тенденция имела место в группе НФ, в то время как в группе с КФП изменения были выражены в одинаковой степени на разных стадиях (p>0,05).
Другие закономерности выявлены при анализе параметров, характеризующих венозные нарушения. Поверхностные вены мозга у больных с КФП были статистически значимо шире по сравнению с таковыми в ГК и у НФ при всех стадиях, при этом расширение нарастало во II и III ст. ГЭ по сравнению с I ст. [с 2,97 (0,22) до 3,97 (0,33) мм]. В группе с КФП III ст. ГЭ установлено также увеличение по сравнению с ГК размеров ПС и большой мозговой вены. В группе НФ эти показатели были сопоставимы с контрольными. Гипоплазия правого или левого поперечных синусов была выявлена у 35 (37,6%) больных с КФП и у 30 (25,9%) с НФ (p>0,05). Тромбоз одного из поперечных синусов диагностирован у 7 (7,5%) больных с КФП и 2 (1,7%) НФ (p>0,05).
Обсуждение
Полученные данные свидетельствуют о том, что гипертоническая энцефалопатия характеризуется гетерогенностью нейровизуализационных и гемодинамических показателей. Определенное значение при этом имеет наличие конституциональной венозной недостаточности. По нашим данным, при гипертонической энцефалопатии на первом и втором структурно-функциональных уровнях сосудистой системы мозга происходят нарастание структурных изменений сосудов и сосудистого сопротивления, депрессия ЛСК. Однако если по ОСА и ВСА статистически значимое снижение ЛСК выявляли лишь во II ст. ГЭ, то по СМА снижение кровотока определяли уже в I ст. ГЭ. Этот факт является подтверждением многочисленных морфологических исследований, указывающих на максимальную выраженность адаптивной перестройки церебрального циркуляторного русла в ответ на патологические повышения АД на уровне терминальных артерий и артериол [15]. Сопоставимая динамика показателей в группах с КФП и НФ свидетельствует о единстве патофизиологических механизмов и минимальном воздействии конституциональной флебопатии на формирование данных нарушений.
Функционально-нагрузочный тест с сублингвальным приемом нитроглицерина широко применяется для оценки реактивности артериальной системы головного мозга. [9]. Для интракраниальных вен не существует единого мнения о сроках и выраженности реакции на этот тест. Однако нитроглицерин является вазодилататором смешанного действия и по чувствительности к нему сосуды располагаются в следующем порядке: вены > артерии > артериолы и капиллярные сфинктеры [18]. Исходя из этого, можно предположить, что показатели реактивности интракраниальных вен при пробе с нитроглицерином являются более информативными, чем показатели реактивности СМА. Повышение IR и ЛСК по ВР в ГК в ответ на введение нитроглицерина, очевидно, свидетельствует об активной реакции со стороны мозговых венозных сосудов [7, 12, 19], что в данной ситуации позволяет предотвратить губительную гиперемию для мозга, находящегося в замкнутом пространстве черепной коробки. Снижение IR и ЛСК по ВР в группе НФ, вероятно, свидетельствует о неадекватном функционировании миогенного механизма ауторегуляции при артериальной гипертонии. Снижение только ЛСК в группе пациентов с КФП может свидетельствовать о неадекватном функционировании миогенного механизма ауторегуляции при артериальной гипертонии у больных с исходной гипотонией венозной стенки.
Повышение фоновых показателей ЛСК по ПС в группе с КФП является одной из составляющих допплерографического паттерна недостаточности венозного оттока из полости черепа и свидетельствует о включении путей коллатерального венозного оттока [12]. При проведении пробы Вальсальвы наблюдались разнонаправленные реакции. В ГК скоростные показатели возрастали, что свидетельствует о включении механизмов ауторегуляции мозгового кровообращения и активации путей коллатерального венозного оттока. У больных гипертонической энцефалопатией независимо от наличия конституциональной венозной недостаточности скоростные показатели снижались, что опять же свидетельствует о неадекватном функционировании механизмов ауторегуляции мозгового кровообращения.
У пациентов с гипертонической энцефалопатией при всех клинических вариантах течения заболевания отмечается расширение ВЯВ в области нижней луковицы, что можно рассматривать как необратимые нарушения венозной циркуляции, возникающие вследствие повышенной нагрузки объемом при артериальной гипертонии. Выявленные наряду с этим аномалии строения брахиоцефальных вен в группе с КФП значительно ограничивают резерв венозного оттока, что может приводить к клинической декомпенсации при повышении артериального притока, при нарушении центральных механизмов венозного оттока, при присоединении патологии контралатеральной вены [13]. Снижение линейных и увеличение объемных параметров кровотока по ВЯВ у больных с КФП могут свидетельствовать о наличии венозного застоя у больных данной группы на фоне веногипотонии.
Усиление кровотока по ПВ при гипертонической энцефалопатии, прежде всего у больных с КФП, позволяет расценивать их как дополнительные пути оттока крови от мозга [11, 13]. Однако отсутствие взаимосвязей между увеличением скорости кровотока по ПВ и гемодинамическими параметрами в интракраниальных венозных сосудах свидетельствует о том, что состояние гемодинамики по ПВ может лишь косвенно отражать состояние интракраниальной венозной гемодинамики.
Данные МРТ подтвердили наличие интракраниального венозного застоя у больных с КФП: увеличение размеров поверхностных вен мозга, прямого синуса и большой мозговой вены.
В нашем исследовании отсутствовала взаимосвязь между показателями гемодинамики сосудов четвертого и пятого структурно-функциональных уровней. По данным МРТ также с одинаковой частотой были выявлены тромбозы внутричерепных синусов у больных как с КФП, так и без таковой. Эти факты, вероятно, свидетельствуют о том, что при гипертонической энцефалопатии тромбоз и несостоятельность магистральных путей венозного оттока могут быть компенсированы включением коллатеральных путей оттока и не являются основной причиной нарушения интракраниальной венозной гемодинамики. Однако, оценивая структуру ВЯВ, состояние остиальных клапанов, гемодинамику по магистральным венам, мы можем выделить группу больных с наличием конституциональной флебопатии с нарушением тонуса и функциональных возможностей интракраниальных вен, что и служит основной причиной развития внутричерепной венозной дисциркуляции при гипертонической энцефалопатии.
Заключение
При гипертонической энцефалопатии выявлены изменения на всех пяти структурно-функциональных уровнях сосудистой системы головного мозга, что требует при инструментальных исследованиях системного подхода к оценке результатов.
При этом патологические процессы, развивающиеся на первом и втором структурно-функциональных уровнях, соответствуют ремоделированию, характерному для артериальной гипертонии, нарастают по мере утяжеления стадии заболевания и не зависят от наличия конституциональной венозной недостаточности. Характер изменений третьего, четвертого и пятого структурнофункциональных уровней в определенной степени зависит от конституционального и наследственного факторов.
Применение алгоритма комплексного УЗ-исследования сосудистой системы головного мозга способствует раскрытию закономерностей возникновения и развития гипертонической энцефалопатии у больных как с интактными венами, так и с конституциональной венозной недостаточностью, что необходимо для оптимизации этиопатогенетической терапии.
Литература
- Варакин Ю.Я. Эпидемиология сосудистых заболеваний головного мозга // Очерки ангионеврологии / Под ред. Суслиной З.А. М.: Атмосфера, 2005. 368 с.
- Котова Е.Ю., Машин В.В. Артериальная гипертония и острое нарушение мозгового кровообращения (по данным регистра инсульта в г. Ульяновске) // Тезисы докладов Российской конференции "Артериальная гипертония: спорные и нерешенные вопросы". Клиническая медицина. 2010. N 1. С. 44-45.
- Суслина З.А., Фонякин А.В., Гераскина Л.А. и др. Практическая кардионеврология М.: ИМА-ПРЕСС, 2010. 304 с.
- Yvonne Teuschl, Michael Brainin. Stroke education: discrepancies among factors influencing prehospital delay and stroke knowledge. International Journal of Stroke. 2010. V. 5, Issue 3. P. 187-208.
- Гипертоническая энцефалопатия: клинико-патогенетические подтипы, классификация, диагностика / Л.А. Белова, В.В. Машин, Ю.М. Никитин, В.Г. Белов. Ульяновск: УлГУ, 2010. 210 с.
- Белова Л.А. Ультразвуковая диагностика гипертонической энцефалопатии с позиции системного подхода (обзор литературы) // Клиническая физиология кровообращения. 2010. N 2. С. 12-15.
- Куликов В.П. Артериовенозная церебральная реактивность на гиперкапнию в диагностике нарушений мозгового кровообращения // Материалы I Международной конференции "Нейросонология и церебральная гемодинамика" // Клиническая физиология кровообращения. 2009. N 4. С. 5-15.
- Кунцевич Г.И., Танашян М.М., Скрылев С.И. и др. Роль ультразвуковых методов исследования на этапах медикаментозного и хирургического лечения сосудисто-мозговой недостаточности // Материалы I Международной конференции "Нейросонология и церебральная гемодинамика". Клиническая физиология кровообращения. 2009. N 4. С. 63-69.
- Лелюк В.Г., Лелюк С.Э. Ультразвуковая ангиология М.: Реальное Время, 2004. 304 с.
- Никитин Ю.М. Алгоритм ультразвуковой диагностики поражений функционально-морфологических уровней кровоснабжения головного мозга в неврологической практике // Журн. неврол. и психиатр. им. С.С. Корсакова. 2007. Вып. 20. С. 46-49.
- Стулин И.Д., Дебиров М.Д., Хорева Е.Т. и др. Энцефалопатия пробуждения - синдром преходящей венозной дисгемии у флебопатов // Клиническая физиология кровообращения. Материалы конференции "Нейросонология и церебральная гемодинамика". М., 2009. С. 33-36.
- Шахнович А.Р., Шахнович В.А. // Клиническая физиология крообращения. Материалы конференции "Нейросонология и церебральная гемодинамика". 2009. N 3. С. 5-15.
- Шумилина М.В. Комплексная ультразвуковая диагностика патологии периферических сосудов. Учебно-методическое руководство. М. НЦССХ им. А.Н. Бакулева РАМН, 2007. 310 с.
- Мчедлишвили Г.И. Спазм артерий головного мозга. Тбилиси: Мецниереба, 1977. 181 с.
- Верещагин Н.В., Гулевская Т.С., Моргунов В.А. Системный подход как основа методологии изучения сосудистых заболеваний головного мозга // Очерки ангионеврологии / Под ред. Суслиной З.А. М.: Атмосфера, 2005. 368 с.
- Белова Л.А., Никитин Ю.М., Машин В.В. и др. Клинико-неврологические и ультразвуковые критерии конституциональной венозной недостаточности при гипертонической энцефалопатии // Кремлевская медицина. Клинический вестник. 2010. Вып. 4 "Неврология". С. 12-15.
- Попова Е.В., Иванов А.Ю., Иванова Н.Е. и др. Взаимосвязь внутричерепного давления и скорости кровотока по позвоночным венам // Ультразвуковая и функциональная диагностика. 2007. N 4. С. 126.
- Харкевич Д.А. Фармакология: учебник / Д.А. Харкевич. 6-е изд., перераб. и доп. М.: ГЭОТАР Медицина, 1999. 664 с.
- Белова Л.А., Машин В.В., Белов В.Г. и др. Оценка состояния реактивности вен Розенталя у больных гипертонической энцефалопатией при нагрузочном тестировании нитроглицерином // Неврол. вестник. 2009. N 3. С. 32-37.

Журнал "SonoAce Ultrasound"
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Публикации по теме
- Возможности ультразвукового метода исследования в диагностике и лечении ложных аневризм висцеральных сосудов - Степанова Ю.А.
- Цветовое дуплексное сканирование в диагностике патологической извитости внутренних сонных артерий - Кузьмичева И.Н.
- Применение алгоритма комплексного ультразвукового исследования сосудистой системы головного мозга при гипертонической энцефалопатии - Белова Л.А.
- Новые измерения ультразвуковой визуализации глубокой венозной системы нижних конечностей. Классификация СЕАР: анатомические аспекты - Алекперова Т.В.
- Ультразвуковое исследование периферической нервной системы - Еськин Н.А.


