Клиническое значение технологии S-Fusion™ при исследовании предстательной железы
Рубрика: Технологии, методики и стандарты
УЗ сканер Samsung HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Перевод статьи: "The Clinical Usefulness of S-Fusion™ for Prostate".
Введение
Рак предстательной железы (РПЖ) – наиболее распространенный вид рака у мужчин в Германии, выявляемый с частотой около 65 000 новых случаев в год [1].
Среди причин смерти от злокачественных новообразований РПЖ находится на третьем месте. В 2011 г. в Германии от РПЖ умерли более 13 000 человек [1].
Риск развития клинически значимого РПЖ зависит от возраста. Десятилетний риск возникновения этого заболевания для 35-летнего мужчины составляет < 0,1%, в то время как для 75-летнего – чуть ниже 6% [1]. В целом пожизненный риск заболевания достигает около 13%, риск смерти в течение жизни – 3,3% [1].
Из-за увеличения продолжительности жизни и улучшения диагностики выявляется больше заболевших РПЖ. Так, число случаев рака значительно возросло после внедрения в практику анализа на маркер опухоли – простатспецифический антиген (ПСА) [2].
Первоначальные патологические изменения в предстательной железе во многих случаях выявляют по повышению уровня ПСА и данным пальцевого ректального обследования. Если результаты этих исследований положительные, в клинических руководствах предлагают провести 10–12-позиционную биопсию предстательной железы под контролем трансректального ультразвука [3].
Однако этот метод биопсии не позволяет выявлять 19–52% всех опухолей и может приводить к недооценке их агрессивности по сравнению с результатами гистологического исследования (после радикальной простатэктомии) или более качественных методов биопсии (32–50%) [4–7].
Тем не менее по мере усовершенствования диагностики появляется возможность обнаруживать опухоли с низкой степенью агрессивности, не влияющие на выживаемость пациентов [8, 9].
При раннем целенаправленном выявлении РПЖ, как правило, удается обнаруживать на ограниченной стадии [10], так что пациенту можно предложить на выбор несколько вариантов лечения: от активного мониторинга или фокальной терапии до общепринятых методов лечения, например радикальной простатэктомии и/или лучевой терапии [11, 12].
Стандартное ультразвуковое исследование
Из урологических методов визуализации для оценки состояния предстательной железы чаще всего используют стандартное трансректальное ультразвуковое исследование (ТРУЗИ). Метод ТРУЗИ идеально подходит для определения объема и облегчает выполнение рандомизированных биопсий предстательной железы. Однако возможности ТРУЗИ для обнаружения РПЖ ограничены, поскольку очаги карциномы часто бывают гипоэхогенные, но также могут быть изо- или гиперэхогенными [13, 14] (рис. 1, 2).
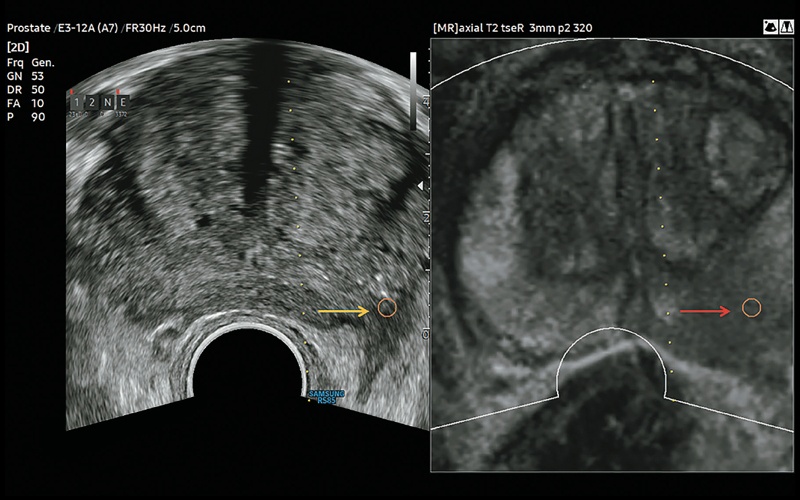
Рис. 1. Совмещенная визуализация предстательной железы: подозрительное небольшое гипоэхогенное образование (желтая стрелка) предстательной железы при обычном УЗИ в В-режиме; при МРТ заподозрена периферическая карцинома со сниженной интенсивностью сигнала слева (красная стрелка). На зарегистрированном комбинированном МРТ-изображении предстательная железа представлена в аксиальной плоскости.
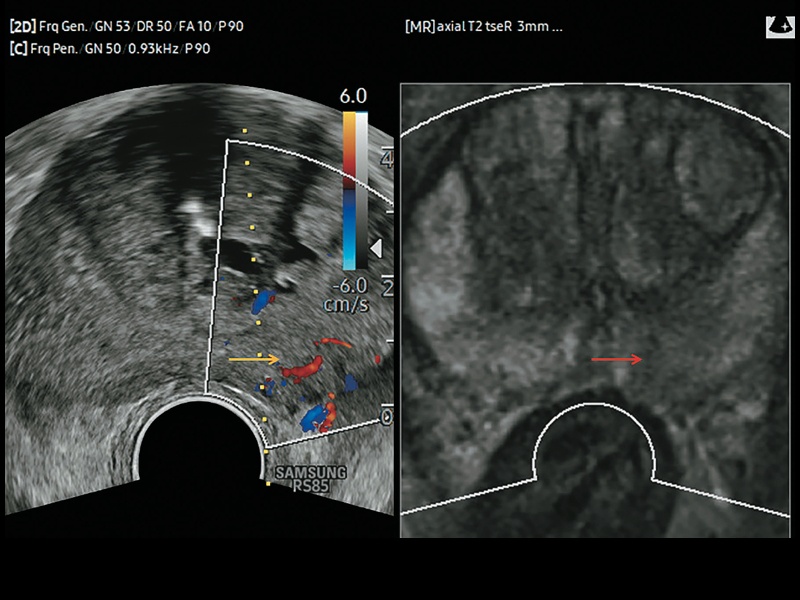
Рис. 2. Комбинированная визуализация предстательной железы. При дуплексном УЗИ с цветовым картированием выявлено поверхностно расположенное образование с повышенной васкуляризацией (желтая стрелка). Слева на Т2-взвешенном МРТ-изображении выявлено образование со сниженной интенсивностью сигнала (гипоинтенсивное), заподозрен рак (красная стрелка).
Это обстоятельство и большая зависимость от оператора, выполняющего исследование [15], вероятно, иногда являются причиной весьма противоречивых результатов в опубликованных исследованиях [15]. Например, гипоэхогенные образования с частотой 18–57% оказались злокачественными [16]. Чувствительность визуализации в этих исследованиях составила 15–96%, специфичность – 46–93% [17–19].
Из-за ограничений общепринятого метода биопсии предстательной железы под контролем ультразвука при обследовании рекомендуют, в отличие от прицельной биопсии других солидных органов, использовать систематическую биопсию.
Мультипараметрическая магнитно-резонансная томография (МРТ) предстательной железы
В настоящее время мультипараметрическую МРТ (mpMRI) считают ведущим методом визуализации для обнаружения и характеристики РПЖ, обладающим высокой диагностической значимостью. МРТ особенно активно используют при сохраняющемся подозрении на рак после отрицательного результата биопсии под контролем трансректального ультразвука [20, 21].
На сегодня мультипараметрическая МРТ позволяет одновременно получать анатомические и функциональные данные. При обследовании используют главным образом морфологическую визуализацию с Т2-взвешенными изображениями (T2W), диффузионно-взвешенными изображениями (DWI) и расширенную визуализацию с динамическим контрастным усилением (DCEMRI) [22].
Преимуществом МРТ является разнообразие вариантов контрастного усиления изображения, позволяющее проводить структурную визуализацию и оценивать различные аспекты состояния здоровой и патологически измененной ткани. Для морфологической визуализации предстательной железы важны T2-взвешенные последовательности высокого разрешения, поскольку они обеспечивают наилучшую визуализацию зональной анатомии предстательной железы и ее капсулы и позволяют оценить распространение опухоли, особенно вне предстательной железы [22, 23].
По этой причине mpMRI облегчает хирургу перед плановой радикальной простатэктомией принятие решения о возможности сохранить нервно-сосудистые пучки [24–26].
С 2012 г. выходят руководства с оценкой результатов применения МРТ [27]. Отдельные поражения классифицируют по системе PI-RADS (prostate imaging reporting and data system – система оценки данных и составления заключения по МРТ) и суммируют результаты по 5-балльной шкале (табл. 1).
| Значение | |
|---|---|
| PI-RADS 1 | Очень низкий (клинический значимый рак крайне маловероятен). |
| PI-RADS 2 | Низкий (клинический значимый рак маловероятен). |
| PI-RADS 3 | Промежуточный (клинический значимый рак умеренно вероятен). |
| PI-RADS 4 | Высокий (клинический значимый рак вероятен). |
| PI-RADS 5 | Очень высокий (клинический значимый рак весьма вероятен). |
Биопсия под контролем комбинированной МРТ
В повседневной практике мы используем ультразвуковую систему RS85 (Samsung Medison Co., Ltd) для комбинированного УЗИ с МРТ простаты.
Для того чтобы выполнить биопсию под контролем комбинированной МР и УЗ визуализиции у пациентов с подозрительными находками при МРТ, используется технология совмещения изображений. Во время этой процедуры ультразвуковое и МР-изображения совмещают в режиме реального времени (рис. 3). В дополнение к систематической биопсии это совмещение изображений можно использовать для биопсии подозрительных участков, выявленных при МРТ [28].
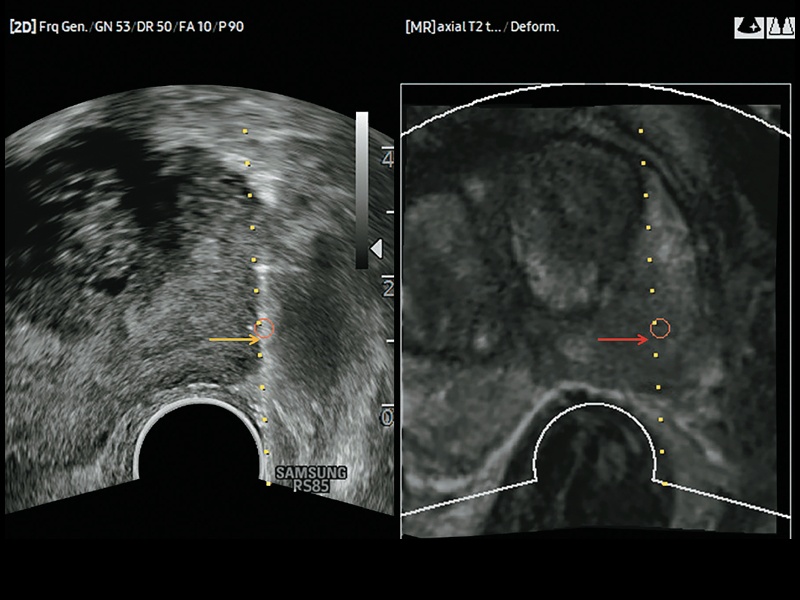
Рис. 3. Прицельной биопсией под контролем комбинированной МР и УЗ визуализации (красные и желтые стрелки) выявили ацинарную аденокарциному предстательной железы (по шкале Глисона 3 + 4 = 7а).
Для этого метода комбинированной визуализации необходимы генератор магнитного поля, совместимые сенсоры, которые устанавливают на трансдьюсере и на теле пациента. Кроме того, на ультразвуковом сканере должно быть установлено соответствующее программное обеспечение. Сенсор трансдьюсера и сенсор на теле пациента обнаруживаются магнитной системой позиционирования, точно рассчитывающей положение сенсоров в зоне проведения исследования. Для комбинированной визуализации можно использовать данные DICOM для всех основных методов томографии. Данные DICOM загружают в ультразвуковую систему и выполняют регистрацию данных на втором этапе. Регистрация изображения может быть выполнена вручную или автоматически, по данным о плоскости или по объемной визуализации [29–31].
После успешного совмещения изображений зарегистрированные МР-изображения перемещаются синхронно с плоскостью ультразвукового изображения. Зарегистрированные изображения можно также просматривать методом наложения или «бок в бок». На комбинированном изображении можно использовать обычные инструменты УЗИ, например цветовую допплерографию, энергетическую допплерографию, УЗИ с контрастированием [32–34].
После запуска программного обеспечения для предстательной железы в системе открывается доступ к алгоритму автоматической калибровки, улучшающему выявление контура предстательной железы и автоматически рассчитывающему ее объем (рис. 4). Кроме того, контур железы можно в той или иной степени исправить вручную (рис. 5).
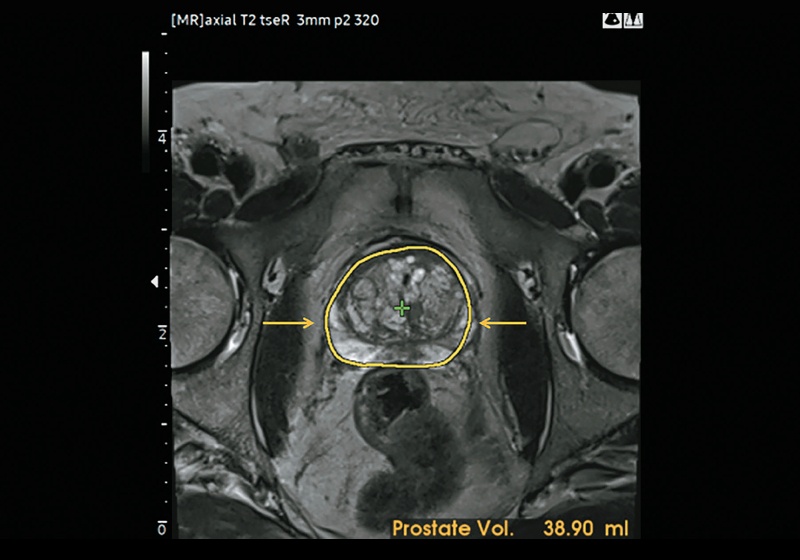
Рис. 4. Алгоритм автоматической калибровки улучшает выявление контура предстательной железы (желтые стрелки) и автоматически вычисляет объем предстательной железы (38,90 мл).
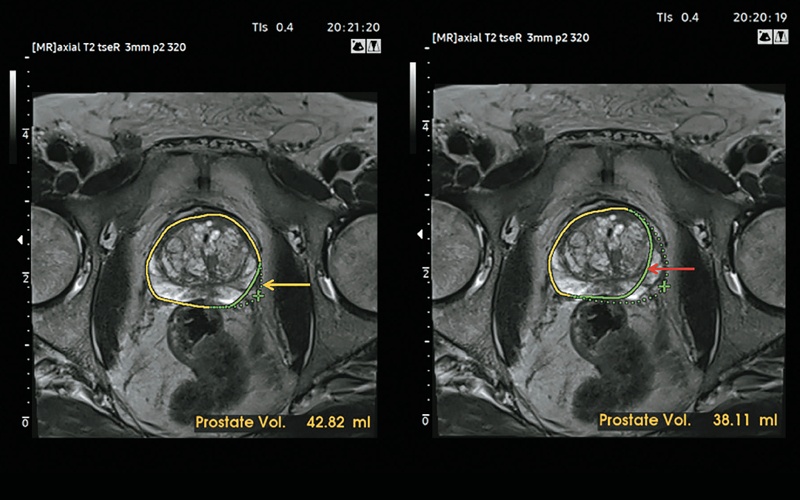
Рис. 5. Кроме того, чтобы рассчитать объем предстательной железы, можно немного (желтая стрелка) или значительно (красная стрелка) исправить ее контур вручную.
В системе можно использовать алгоритм коррекции деформаций, повышающий точность регистрации путем коррекции на деформацию ткани предстательной железы, возникающую при надавливании датчиком во время исследования, что также может быть полезно в случае прицельной биопсии (рис. 6–9).
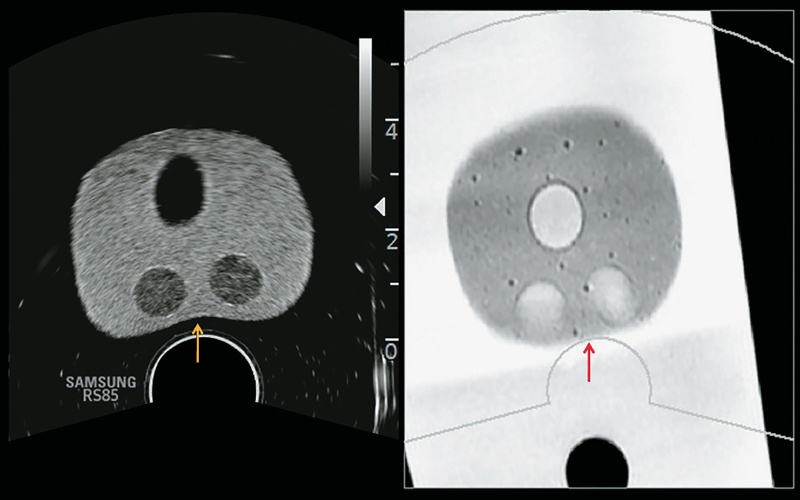
Рис. 6. Во время исследования датчик сдавливает ткань предстательной железы (желтая стрелка), деформируя ее и нарушая соответствие между данными УЗИ и МРТ (красная стрелка).
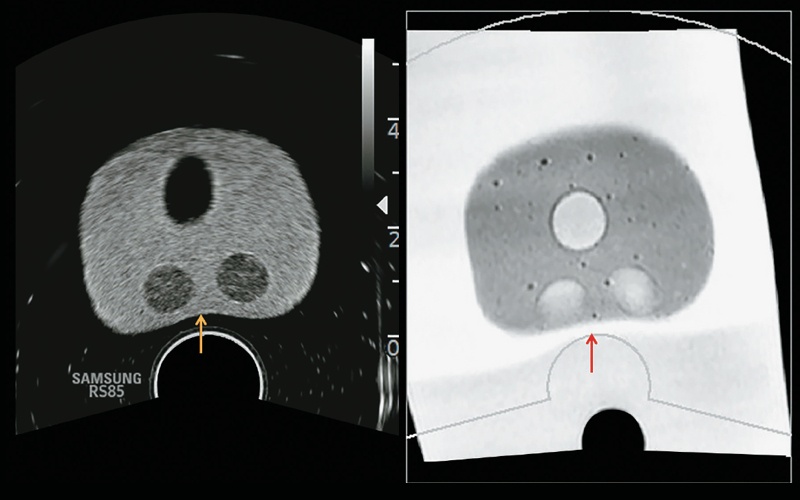
Рис. 7. Алгоритм коррекции деформации в системе позволяет повысить точность регистрации, корригируя деформацию предстательной железы на МР-изображении (красная стрелка) при сдавлении ткани датчиком (желтая стрелка) во время исследования.
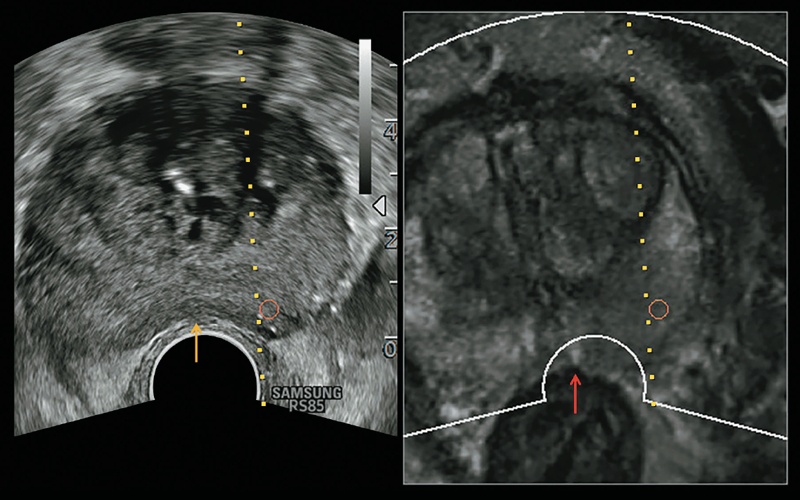
Рис. 8. Во время исследования датчик сдавливает ткань предстательной железы (желтая стрелка), вызывая несоответствие между местоположением предстательной железы и контуром предстательной железы на МР-изображении (красная стрелка).
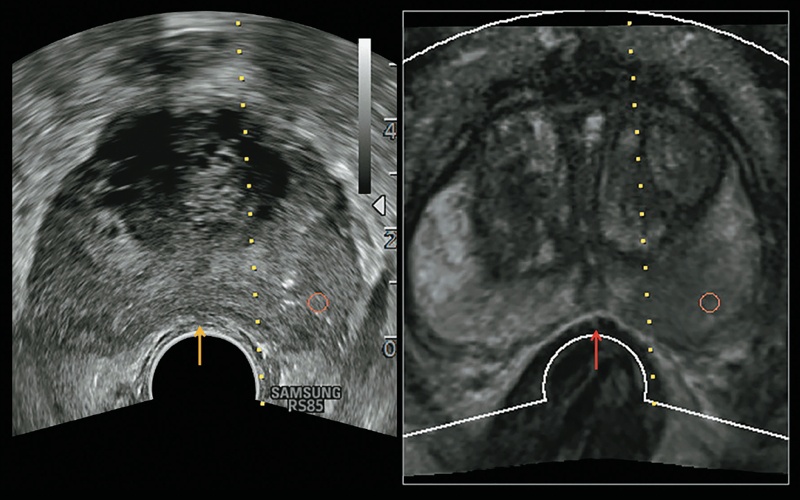
Рис. 9. Пациент с рис. 8. Алгоритм коррекции деформаций в системе повышает точность регистрации, корригируя деформацию предстательной железы на МР-изображении (красная стрелка) при сдавливании ткани датчиком (желтая стрелка).
Для компенсации возможных движений доступен специальный трекер пациента, позволяющий изменять положение пациента во время вмешательства без необходимости повторно регистрировать данные МРТ.
Регистрация ультразвуковых и МР-изображений при комбинированной визуализации улучшает пространственную ориентацию и позволяет лучше обнаруживать подозрительные очаговые образования и прицельно проводить их биопсию. Кроме того, этот метод позволяет оценить микроваскуляризацию, непосредственно сравнивая ее с изображениями в срезе [35–37].
В клинической практике метод комбинированной визуализации можно использовать для биопсии предстательной железы или после инвазивных процедур [38–43].
Вся процедура занимает менее 10 мин, включая загрузку данных МРТ в ультразвуковую систему, регистрацию изображения и выполнение биопсии. Во время регистрации также автоматически определяется объем предстательной железы, и в наборе данных 3D-МРТ можно отобразить ранее проведенные биопсии. Технология S-Fusion™ для предстательной железы поддерживает функцию автоматической калибровки в режиме реального времени, повышающую точность и надежность проведения вмешательств. 3D-моделирование предстательной железы по наборам данных МРТ обеспечивает безопасную навигацию и точное прицеливание во время биопсии, а также позволяет локализовать область биопсии в объемном изображении предстательной железы (рис. 10–14).
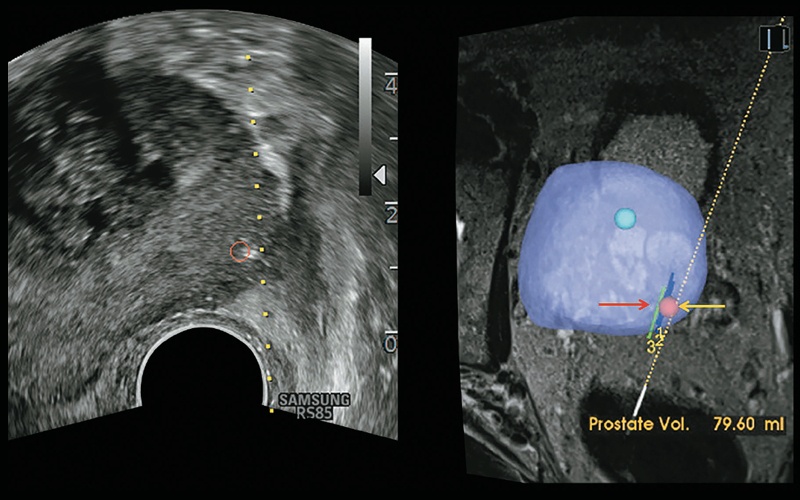
Рис. 10. 3D-моделирование предстательной железы позволяет на основе созданных наборов данных МРТ точно прицелиться во время биопсии железы. Также это позволяет локализовать область биопсии. Подозрительное образование помечено в виде сферы красного цвета (желтая стрелка); в модели предстательной железы представлены ранее проведенные биопсии (красная стрелка).
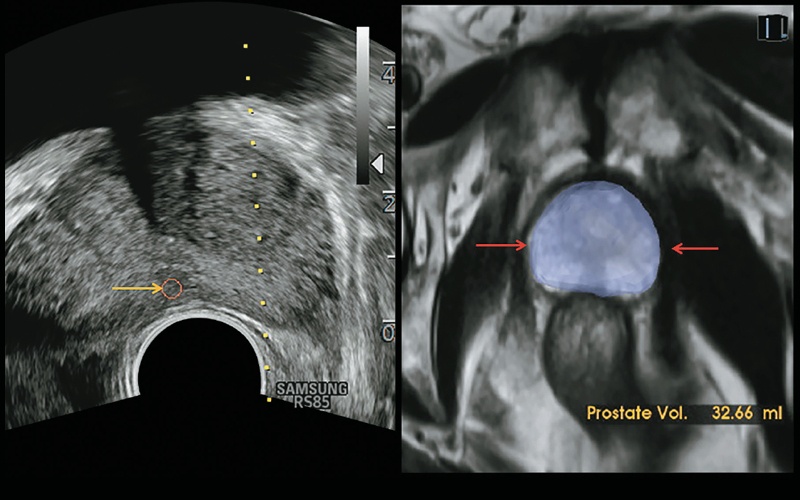
Рис. 11. Технология автокалибровки S-Fusion™ для предстательной железы обеспечивает функцию автоматической калибровки в режиме реального времени, повышающую точность и надежность проведения вмешательств. Система автоматически определяет контур предстательной железы (красные стрелки) и измеряет ее объем (32,6 мл). Подозрительное образование также обнаружено на обычном B-изображении (желтая стрелка).
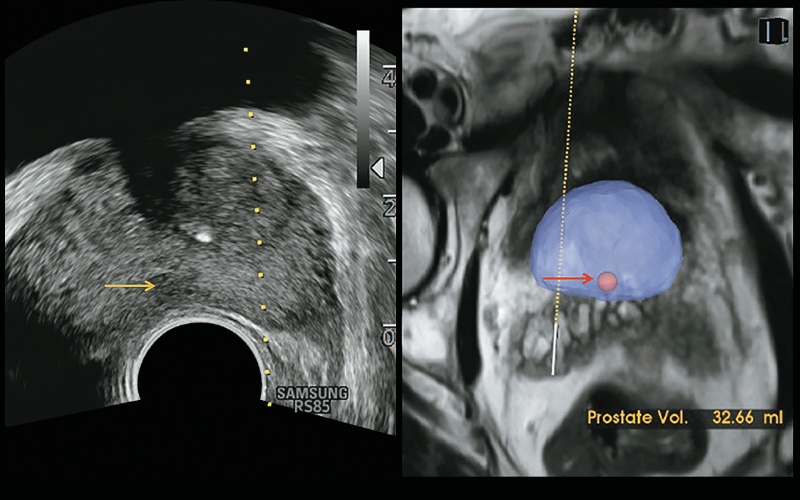
Рис. 12. Технология S-Fusion™ переносит обнаруженное на обычном B-изображении поражение-мишень (желтая стрелка) в 3D-объем (красная стрелка). Кроме того, во время инвазивной процедуры отображается объем предстательной железы (32,6 мл).
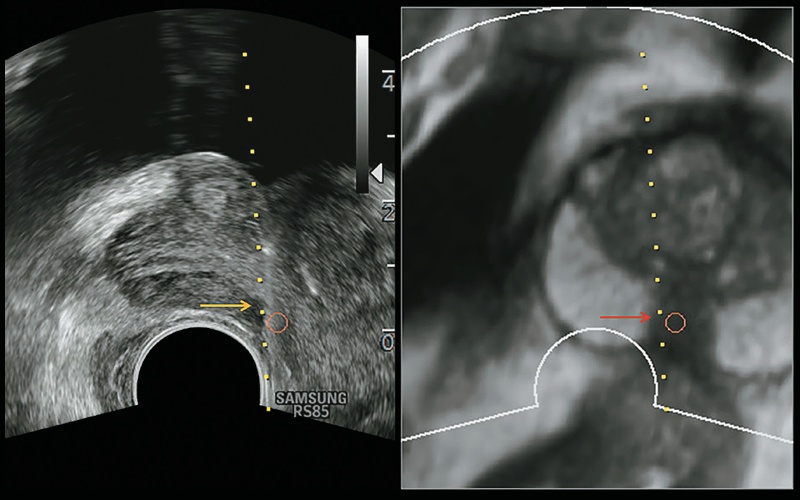
Рис. 13. При прицельной биопсии под контролем комбинированной МР и УЗ визуализации (красные и желтые стрелки) выявлена низкодифференцированная ацинарная карцинома предстательной железы (по шкале Глисона 4 + 4 = 8 баллов).
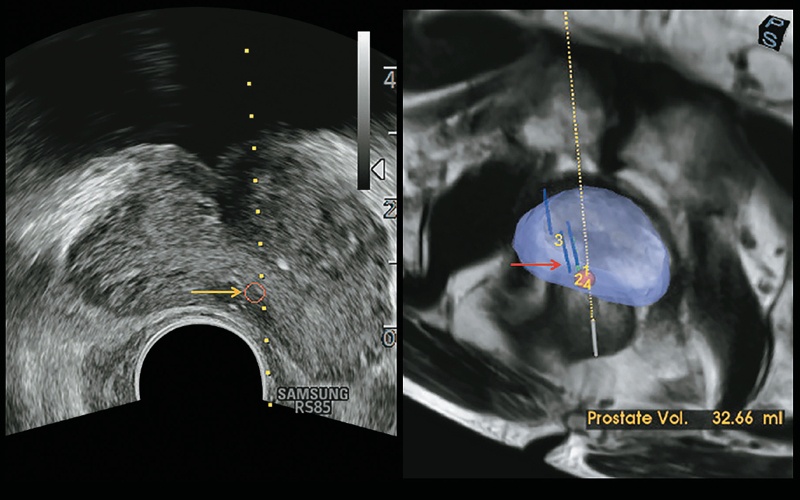
Рис. 14. Программное обеспечение для комбинированной визуализации предстательной железы позволяет на основе 3D-модели точно прицелиться для биопсии железы. Подозрительное образование отмечено на МР-томограмме в виде сферы красного цвета и в обычном B-режиме (желтая стрелка). На изображении предстательной железы показаны ранее проведенные биопсии (красная стрелка).
Заключение
До настоящего времени «золотым стандартом» подтверждения диагноза РПЖ считают 12-позиционную биопсию железы под контролем трансректального ультразвука. Этот традиционный метод широко доступен и экономически эффективен. В последние годы появились новые клинические и технические разработки в области МРТ и методы прицельной биопсии под контролем визуализации, позволившие значительно улучшить выявление, локализацию и оценку стадии РПЖ [44, 45].
Чувствительность обнаружения клинически значимых опухолей по сравнению с 12-позиционной биопсией под контролем трансректального ультразвука удалось значительно увеличить путем интеграции в процедуру биопсии многопараметрической МРТ (mpMRI), в настоящее время признанной лучшим методом визуализации предстательной железы [40, 46].M.M. Siddiqui и соавт. [40] в опубликованной когорте из 1003 пациентов показали, что биопсия под контролем комбинированной МРТ/ТРУЗИ-визуализации по сравнению с обычной биопсией позволяет обнаруживать на 30% больше значимых случаев РПЖ высокого риска (р < 0,001) и в то же время на 17% меньше случаев незначимого РПЖ (р = 0,002). Значимость метода биопсии под контролем комбинированной МРТ-визуализации для показаний к повторной биопсии убедительно подтверждена в исследованиях с участием нескольких тысяч пациентов [40, 47–51].
Поддерживаемые системы: RS85.
Литература
- Robert-Koch-Institut. Prostatakrebs. http://www.krebsdaten.de/Krebs/DE/Content/Krebsarten/Prostatakrebs/prostatakrebs_node.html
- Herlemann A., Kretschmer A., Apfelbeck M. et al. Prostate Cancer – Update 2017 // MMW Fortschr Med. 2017; 159 (4): 58–65.
- Deutsche Gesellschaft für Urologie e. V. Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadiendes Prostatakarzinoms 2014. Deutsche Gesellschaft für Urologie e. V., Düsseldorf.
- Roethke M.1, Anastasiadis A.G., Lichy M. et al. MRI-guided prostate biopsy detects clinically significant cancer: analysis of a cohort of 100 patients after previous negative TRUS biopsy // Wld J Urol. 2012; 30 (2): 213–218. doi: 10.1007/s00345-011-0675-2. Epub 2011 Apr 22.
- Shaw G.L., Thomas B.C., Dawson S.N. et al. Identification of pathologically insignificant prostate cancer is not accurate in unscreened men // Br J Cancer. 2014; 110 (10): 2405–2411.
- Siddiqui M.M., Rais-Bahrami S., Turkbey B. et al. Comparison of MR/ultrasound fusion-guided biopsy with ultrasound-guided biopsy for the diagnosis of prostate cancer // JAMA. 2015; 313 (4): 390–397.
- Ukimura O., Coleman J.A., de la Taille A. et al. Contemporary role of systematic prostate biopsies: indications, techniques, and implications for patient care // Eur Urol. 2013; 63 (2): 214–230.
- Eggener S.E., Badani K., Barocas D.A. et al. Gleason 6 Prostate Cancer: Translating Biology into Population Health // J Urol. 2015; 194 (3): 626–634.
- Lund L., Svolgaard N., Poulsen M.H. Prostate cancer: a review of active surveillance // Res Rep Urol. 2014; 16 (6): 107–112.
- Hoedemaeker R.F. et al. Histopathological prostate cancer characteristics at radical prostatectomy after population based screening // J Urol. 2000; 164: 411–415.
- Mottet N. et al. EAU-ESTRO-SIOG Guidelines on Prostate Cancer. Part 1: Screening, Diagnosis, and Local Treatment with Curative Intent // Eur Urol. 2016. DOI: 10.1016/j.eururo.2016.08.003
- Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms, Kurzversion 3.1, AWMF Registernummer: 043/022OL, http://leitlinienprogrammonkologie.de/ Leitlinien.7.0.html
- Dahnert W.F., Hamper U.M., Eggleston J.C. et al. Prostatic evaluation by transrectal sonography with histopathologic correlation: the echopenic appearance of early carcinoma // Radiology. 1986; 158: 97–102.
- Shinohara K., Wheeler T.M., Scardino P.T. The appearance of prostate cancer on transrectal ultrasonography: correlation of imaging and pathological examinations // J Urol. 1989; 142: 76–82.
- Halpern E.J., Strup S.E. Using gray-scale and color and power Doppler sonography to detect prostatic cancer // Am J Roentgenol. 2000; 174: 623–627.
- Frauscher F., Klauser A., Halpern E.J. Advances in ultrasound for the detection of prostate cancer // Ultrasound quarterly. 2002; 18: 135–142.
- Brock M., Von Bodman C., Sommerer F. et al. Comparison of real-time elastography with grey-scale ultrasonography for detection of organ-confined prostate cancer and extra capsular extension: a prospective analysis using whole mount sections after radical prostatectomy // BJU international. 2011; 108: E217–222.
- Lee F., Siders D.B., Torp-Pedersen S.T. et al. Prostate cancer: transrectal ultrasound and pathology comparison. A preliminary study of outer gland (peripheral and central zones) and inner gland (transition zone) cancer // Cancer. 1991; 67: 1132–1142.
- Rorvik J., Halvorsen O.J., Servoll E. et al. Transrectal ultrasonography to assess local extent of prostatic cancer before radical prostatectomy // Br J Urol. 1994; 73: 65–69.
- Rosenkrantz A.B., Verma S., Turkbey B. Prostate cancer: top places where tumors hide on multiparametric MRI // Am J Roentgenol. 2015; 204 (4): W449–W456.
- Fütterer J.J., Briganti A., De Visschere P. et al. Can clinically significant prostate cancer be detected with multiparametric magnetic resonance imaging? A systematicreviewoftheliterature // Eur Urol. 2015; 68: 1045–1053.
- Dickinson L., Ahmed H., Clare A. et al. Magnetic resonance imaging for the detection, localisation, and characterisation of prostate cancer: recommendations from a European consensus meeting // Eur Urol. 2011; l59 (4): 477–494.
- Gupta R.T., Spilseth B., Patel N. et al. Multiparametric prostate MRI: focus on T2-weighted imaging and role in staging of prostate cancer // Abdom Radiol. 2016; 41 (5): 831–843.
- Koksal I.T., Ozcan F., Kadioglu T.C. et al. Discrepancy between Gleasonscores of biopsy and radical prostatectomy specimens // Eur Urol. 2000; 37 (6): 670–674.
- Nörenberg D., Solyanik O., Schlenker B. et al. MRI of the prostate // Urologe A. 2017; 56 (5): 665–677.
- Solyanik O., Schlenker B., Gratzke C. et al. Imaging of locally advanced prostate cancer: Importance of ultrasound and especially MRI // Urologe A. 2017; 56 (11): 1383–1393.
- Barentsz J.O., Richenberg J., Clements R. et al. ESUR prostate MR guidelines. 2012. European Society of Urogenital Radiology // Eur Radiol. 2012; 22 (4): 746–757.
- Schlenker B., Clevert D.A., Salomon G. Sonographic imaging of the prostate // Urologe A. 2014; 53 (7): 1052–1060.
- Wein W., Brunke S., Khamene A. et al. Automatic CT-ultrasound registration for diagnostic imaging and image-guided intervention // Medical Image Analysis. 2008; 12: 577–585.
- Wein W., Khamene A., Clevert D.A. et al. Simulation and fully automatic multimodal registration of medical ultrasound. Medical image computing and computer-assisted intervention: MICCAI ... // International Conference on Medical Image Computing and Computer-Assisted Intervention. 2007; 10: 136–143.
- Zikic D., Wein W., Khamene A. et al. (2006) Fast deformable registration of 3D-ultrasound data using a variational approach. Medical image computing and computer-assisted intervention: MICCAI ... // International Conference on Medical Image Computing and Computer-Assisted Intervention. 2006; 9: 915–923.
- Clevert D.A., Helck A., D’anastasi M. et al. Ultraschallgesteuerte EVAR-Interventionen und Follow-up-Diagnostik mit der kontrastmittelgestützten Sonographie und der Bildfusion // Gefässchirurgie. 2011; 16: 490–497.
- Clevert D.A., Helck A., Paprottka P.M. et al. Latest developments in ultrasound of the liver // Der Radiologe. 2011; 51: 661–670.
- Clevert D.A., Helck A., Paprottka P.M. et al. Ultrasound-guided image fusion with computed tomography and magnetic resonance imaging. Clinical utility for imaging and interventional diagnostics of hepatic lesions // Der Radiologe. 2012; 52: 63–69.
- Clevert D.A., D'anastasi M., Jung E.M. Contrast-enhanced ultrasound and microcirculation: efficiency through dynamics--current developments // Clin Hemorheol Microcirc. 2013; 53: 171–186.
- Clevert D.A., Sterzik A., Braunagel M. et al. Modern imaging of kidney tumors // Der Urologe. Ausg. A. 2013; 52: 515–526.
- Helck A., Notohamiprodjo M., Danastasi M. et al. Ultrasound image fusion – clinical implementation and potential benefits for monitoring of renal transplants // Clinical Hemorheol Microcirc. 2012; 52: 179–186.
- Hadaschik B.A., Kuru T.H., Tulea C. et al. A novel stereotactic prostate biopsy system integrating preinterventional magnetic resonance imaging and live ultrasound fusion // J Urol. 2011; 186: 2214–2220.
- Siddiqui M.M., Rais-Bahrami S., Truong H. et al. Magnetic resonance imaging/ultrasound-fusion biopsy significantly upgrades prostate cancer versus systematic 12-core transrectal ultrasound biopsy // Eur Urol. 2013; 64 (5): 713–719.
- Siddiqui M.M., Rais-Bahrami S., Turkbey B. et al. Comparison of MR/ultrasound fusion-guided biopsy with ultrasound-guided biopsy for the diagnosis of prostate cancer // JAMA. 2015; 313 (4): 390–397.
- Apfelbeck M., Clevert D.A., Ricke J. et al. Contrast enhanced ultrasound (CEUS) with MRI image fusion for monitoring focal therapy of prostate cancer with high intensity focused ultrasound (HIFU) // Clin Hemorheol Microcirc. 2018; 69 (1–2): 93–100.
- Schlenker B., Apfelbeck M., Buchner A. et al. MRI-TRUS fusion biopsy of the prostate: Quality of image fusion in a clinical setting // Clin Hemorheol Microcirc. 2018; 70 (4): 433–440.
- Schlenker B., Apfelbeck M., Armbruster M. et al. Comparison of PIRADS 3 lesions with histopathological findings after MRI-fusion targeted biopsy of the prostate in a real world-setting // Clin Hemorheol Microcirc. 2019; 71 (2): 165–170.
- Ahmed H.U., El-Shater Bosaily, Brown L.C. et al. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study // Lancet. 2007; 389 (16): 815–822.
- Graham J., Kirkbride P., Cann Ketal. Prostate cancer: summary of updated NICE guidance // Br Med J. 2014; 7524: 348.
- Panebianco V., Barchetti F., Sciarra A. et al. Multiparametric magnetic resonance imaging vs. standard care in men being evaluated for prostate cancer: a randomized study // Urol Oncol. 2015; 33 (1): 17.e1–7.
- Kuru T.H., Roethke M.C., Seidenader J. et al. Critical evaluation of magnetic resonance imaging targeted, transrectal ultrasound guided transperineal fusion biopsy for detection of prostate cancer // J Urol. 2013; 190 (4): 1380–1386.
- Radtke J.P., Kuru T.H., Boxler S. et al. Comparative analysis of transperineal template saturation prostate biopsy versus magnetic resonance imaging targeted biopsy with magnetic resonance imaging-ultrasound fusion guidance // J Urol. 2015; 193 (1): 87–94.
- Siddiqui M.M., Rais-Bahrami S., Truong H. et al. Magnetic resonance imaging/ultrasound-fusion biopsy significantly upgrades prostate cancer versus systematic 12-core transrectal ultrasound biopsy // Eur Urol. 2013; 64 (5): 713–719.
- Valerio M., Donaldson I., Emberton M. et al. Detection of clinically significant prostate cancer using magnetic resonance imaging-ultrasound fusion targeted biopsy: a systematic review // Eur Urol. 2014; 65: 124–137.
- Distler F., Radtke J.P., Kesch C. et al. Value of MRI/ultrasound fusion in primary biopsy for the diagnosis of prostate cancer // Urologe A. 2016; 55 (2): 146–155.

УЗ сканер Samsung HS50
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Публикации по теме
- Ультразвуковая технология автоматического отслеживания местоположения нерва в практике обезболивания - Jee Youn Moon
- Сравнение программы S-Detect™ и стандартного УЗИ щитовидной железы для распознавания новообразований в соответствии с классификацией Британской ассоциации по щитовидной железе (British Thyroid Association – BTA) - Matthew Southam
- Клиническое значение технологии S-Fusion™ при исследовании предстательной железы - Dirk Clevert
- Значение 4D HyCoSy при оценке проходимости маточных труб - Shaoqi Chen
- Применение 5D Heart Color™ для полуавтоматической оценки структур сердца плода в широкой клинической практике - Jan Weichert

