Электрохимический лизис метастазов печени под ультразвуковым контролем (возможности и перспективы)
Рубрика: Эхография брюшной полости
УЗ сканер Samsung Z20
Аппарат премиум-класса для тех, кто ценит точность, скорость и удобство. Новый стандарт в области женского здоровья.
Введение
Интервенционная радиология ставит перед клиницистами новые вопросы по оценке эффективности малоинвазивного локального лечения очаговых поражений печени [1, 2, 4]. Наряду с оценкой ответа на лечение, выживаемостью, профилактикой ранних и поздних осложнений актуальными становятся проблемы стоимости лечения и используемого инструментария. Исходя из этих позиций, в онкогастроэнтерологии ведется постоянный поиск новых малоинвазивных способов лечения злокачественных очаговых поражений печени [3, 5, 8].
Цель работы: провести оценку клинической эффективности электрохимического лизиса в паллиативном лечении нерезектабельных метастазов в печени из различных первичных опухолей через 12 месяцев после лечения.
Материалы и методы
В течение 2002-03 годов в клинике факультетской терапии и хирургии СГМА на базе МЛПУ "Клиническая больница N 1" проведены сеансы электрохимического лизиса (от 1 до 5) у 35 человек с единичными метастазами в печень (от 1 до 5) после комбинированного лечения злокачественных опухолей различных локализаций. Распределение пациентов по локализации первичной опухоли: колоректальный рак - 8, желудок - 7, поджелудочная железа - 4, меланома - 2, желчный пузырь - 2, молочная железа - 3 случая, другие локализации - 5. У 27 пациентов метастазы в печени были метахронными, у 8 человек - синхронными. Использовалась классификация метастазов в печени по L. Gennari и соавт., 1984 (табл. 1).
| Стадии | Количество пациентов |
|---|---|
| I (H1s) | 22 |
| II (H2s, H1m, b) | 9 |
| III (H2m, b, H3s, m, b, i) | 4 |
| IV (I-III+A, B) | - |
| Всего | 35 |
Диагностический алгоритм был стандартизирован.
Диагностический алгоритм при подозрении на метастатическое поражение печени (Лемешко З.А., Борсуков А.В.).
- УЗ-томография (В-режим + ЭД) 1/7 дней.
- Экспертная оценка УЗ-изображения.
- Мультифокальная биопсия сомнительных участков (G210->G20P->G20P).
- КT 1/3 мес.
В 28 случаях электрохимического лизиса проводилось чрескожно под УЗ-контролем, у 7 пациентов лечение проведено интраоперационно. Использовались чрескожные введения моно- и биполярных платиновых электродов (ECU-ЗОО, "Soring ", Германия) диаметром 2,0 и 2,5 мм (табл. 2).
| Метод лечения | Характеристика | Доступ | Кратность | Количество сеансов | |
|---|---|---|---|---|---|
| интраопер. | чрескожн. | ||||
| Электрохимический лизис (n=35) | I=80-1000 mA t=20-45 мин. |
7 | 28 | 2 р/нед. | 1-8 |
Позиционирование электродов в очаге основывалось на принципе параллельности, деления очага на 3 сегмента и зависимости расстояния между электродами от радиуса очага, но не более 15 мм (рис. 1).
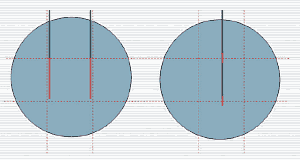
Рис. 1. Позиционирование электродов при электрохимическом лизисе.
Центральным звеном оценки эффективности электрохимического лизиса являлась мультифокальная биопсия метастаза сразу же после лизиса и через 5, 10, 15 дней после лечения. Цито- и гистологическая оценка проводилась с позиций патоморфоза тканей после лечения, принятых в онкологии.
Степени патоморфоза опухоли после лечения (Лушников Е.Ф.).
- Дистрофия отдельных клеток.
- Очаги некроза + дистрофия клеток.
- Поля некроза + выраженная дистрофия клеток + единичные атипичные клетки.
- Тотальный некроз.
Принцип электрохимического лизиса основывается на прямом воздействии постоянного тока на метастаз с возникновением асептического некроза (1-й этап) и отсроченного химического воздействия на опухоль продуктами электролиза в виде щелочи, кислоты и соединений платины (2 этап). Процесс электрохимического лизиса не сопровождается повышением температуры, что принципиально отличает этот метод от радиочастотной аблации. Отсутствие температурных колебаний улучшает переносимость самой манипуляции, что позволяет проводить лизис под местной анестезией.
Для оценки индекса качества жизни применен общий опросник SF-36 и модуль специфического опросника EORTC QLQ-PC для паллиативного лечения онкологических больных.
Результаты исследования
45% всех пациентов имели тяжелую сопутствующую патологию (ИБС, бронхиальная астма, сахарный диабет в стадии декомпенсации). У 70% больных с метастазами оперативное их удаление было невозможно по общему клиническому состоянию, у 29% - очаги были нерезектабельны.
После морфологической верификации метастазов проводили сеансы электрохимического лизиса с силой тока 80 мА (n-4) и 100 мА (n-8) длительностью от 20 до 40 минут. Применялись две группы оценочных критериев: цитологический и ультразвуковой во время сеансов, и гистологический + ультразвуковой в отсроченном (до 3 месяцев) и отдаленном периодах (12 месяцев наблюдения). Зоны патоморфоза отличались при различных режимах электрохимического лизиса (рис. 2).
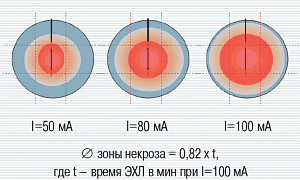
Рис. 2. Распределение зон патоморфоза при различных режимах электрохимического лизиса.
Округлая зона повышения эхогенности в очаге во время электрохимического лизиса у всех пациентов соответствовала некрозу метастаза (рис. 3а). В случае появления звездчатой зоны в проекции очага во время лизиса (в 34,7%), манипуляция считалась малоэффективной, так как имелся патоморфоз I-III степеней и требовалось изменение позиции электрода и режима электрохимического лизиса (рис. 3б).
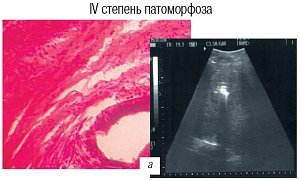
а) Cправа УЗ-томограмма зоны метастаза в виде эхопозитивного округлого образования.
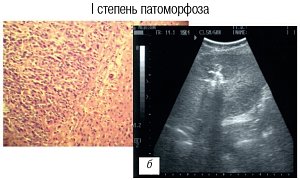
б) Cправа УЗ-томограмма зоны метастаза в виде эхопозитивного звездчатого образования.
Мы связываем это с локализацией электрода на сосудах с дальнейшим перераспределением электропроводности между кровью и тканями. Наблюдалась резкое снижение гемодинамики в очаге после лизиса и усиление кровотока в паренхиме печени вокруг метастаза в течение 5-17 дней после электрохимического лизиса (рис. 4).
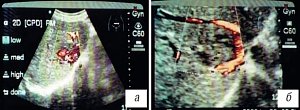
Рис. 4. УЗ-томограммы метастаза в режиме энергетического допплера.
а) Слева до электрохимического лизиса.
б) Через 10 дней после лизиса.
При динамической компьютерной томографии у 8 пациентов отмечалось появление пузырьков воздуха в проекции очага после электрохимического лизиса, исчезающих через 1-2 месяца (рис. 5).
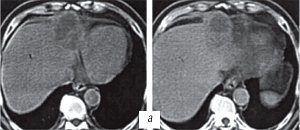
а) До электрохимического лизиса.
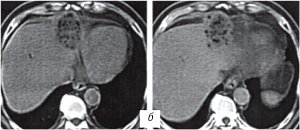
б) Через 10 дней после электрохимического лизиса, определяются пузырьки воздуха в проекции очага.
У 6 человек проведены контрольные биопсии через 6 месяцев, а у 5 человек - через 12 месяцев после лечения выявлена грубоволокнистая рубцовая ткань в зоне очага без признаков опухолевого роста. При УЗ-мониторинге границы остаточного очага нечеткие, структура его неоднородная, эхогенность по сравнению с исходным состоянием снижена. В зоне электрохимического лизиса новых фокусов метастазов не выявлено в течение всего срока наблюдения (12 месяцев).
При анализе осложнений выделены две группы:
- Непосредственно связанные с манипуляцией: подкапсульные гематомы (34% - на период освоения методики, 8% - в дальнейшем); болевой синдром при электрохимическом лизисе (по визуально-аналоговой шкале 4-6 баллов), 27%); внутрибрюшное кровотечение (3%), тромбоз мелких венозных сосудов (13%).
- Специфические побочные эффекты электрохимического лизиса: чувство "ударов " электротоком - непосредственное осложнение (12%); токсический гепатит в виде отсроченного осложнения (84%).
Появление гематом и кровотечения обусловлено начальными этапами работы (отработка методики, несовершенство электродов), которые были ликвидированы через 3 месяца после начала работы. Выбрана оптимальная локализация электродов: не менее 20 мм от крупных сосудов диаметр электродов не должен превышать 2 мм. Купирование болевого синдрома остается полностью нерешенной проблемой, так как возникающая боль обусловлена механизмом электрохимического лизиса: возникновение пенистого субстрата в зоне метастаза с увеличением давления во всех зонах по закону Паскаля. Ощущение "ударов " электротоком возникало у 4 пациентов, где применялись электроды со временем работы более 120 минут (следствие микротрещин изоляции). В дальнейшем использование электродов было ограничено 90 минутами электрохимического лизиса и подобные жалобы полностью исчезли.
Морфологическим субстратом токсического гепатита у 28 пациентов являлось образование тканевого детрита в зоне метастаза во время и после сеанса электрохимического лизиса. Детрит имел жидкостную консистенцию в зоне локализации электродов, так как был разбавлен пенистыми продуктами лизиса тканей под воздействием постоянного тока с рН <6,0 у анода и с рН >8,0 вокруг катода. Гепатит имел доброкачественное клиническое течение и полностью купировался в течение одного месяца по клиническим данным. Качество жизни пациентов улучшалось в течение 1-3 месяцев, стабилизировалось на 4-6 месяцев и медленно снижалось к 12-му месяцу. Каждый сеанс электрохимического лизиса улучшал индекс качества жизни на 15-20 дней.
Полный ответ на лечение (применялись стандартные методики, принятые в онкологии [1, 4]) наблюдался у 14 пациентов с размером очагов до 40 мм (34,2%), частичный - у 10 пациентов (24,3%), стабилизация процесса отмечалась у 8 человек (19,5%), прогресс - 22 больных (табл. 3). Даже при отсутствии полного ответа целесообразны повторные сеансы электрохимического лизиса для проведения циторедуктивной терапии (наиболее оптимальные сроки повторного лизиса приведены в табл. 3 в закрашенных ячейках). Шестимесячная выживаемость составила у пациентов с неколоректальными метастазами 78%, с колоректальными - 89%, одногодичная выживаемость составила 67 и 85,5% соответственно.
| Ответ на лечение | Количество месяцев | ||||
|---|---|---|---|---|---|
| 1 | 3 | 6 | 9 | 12 | |
| Полный | 14 | 14 | 14 | 14 | 14 |
| Частичный | 10 | 10 | 7 | 5 | 4 |
| Стабилизация | 8 | 5 | 4 | 4 | 1 |
| Прогресс | 9 | 12 | 16 | 18 | 22 |
Выводы
- Метод электрохимического лизиса возможен для применения в паллиативном лечении метастазов в печени.
- Побочные эффекты после электрохимического лизиса минимальны при технически грамотном соблюдении режима лизиса.
- Электрохимический лизис эффективно при метастазах размером до 40 мм С 1-100 тА и экспозицией 30-40 мин. Повторные курсы электрохимического лизиса показаны у всех пациентов для реализации циторедуктивной терапии.
- Малоинвазивная методика электрохимического лизиса - операторозависимый метод, и для уменьшения риска побочных эффектов рекомендуется к использованию в лечебных учреждениях, имеющих подготовленных специалистов в интервенционной радиологии или малоинвазивной хирургии.
Литература
- Гранов Д.А., Таразов П.Г. Рентгеноэндоваскулярные вмешательства в лечении злокачественных опухолей печени. СПб.: Фолио, 2002. 287с.
- Пономарев А.А., Куликов Е.П., Караваев Я.С. Опухоли и опухолеподобные образования печени и желчных протоков. Рязань, 2000. 373с.
- Шапошников А.В. Ятрогения. Ростов-на-Дону, 1999. 168с.
- Актуальные вопросы диагностики и хирургического лечения метастатического рака печени // Материалы III Российско-германского симпозиума. М., 2001. 267 с.
- Материалы 10 конференции хирургов-гепатологов России и СНГ. М. 2003. 236 с.
- Malignant Liver Tumors: Basic Concepts and Clinical Management. Leipzig. 2002. 98 p.
- Medical Imaging in Gastroenterology and Hepatology. Hannover. 2001. 148 p.
- Malignant Liver Tumours: Basic Concepts and Clinical Management. Leipzig. 2002. 214 p.

УЗ сканер Samsung Z20
Аппарат премиум-класса для тех, кто ценит точность, скорость и удобство. Новый стандарт в области женского здоровья.
Публикации по теме
- Случай ультразвуковой диагностики мальтомы двенадцатиперстной кишки - Арутюнов А.Г.
- Тератома желудка (редкое наблюдение из практики врача лучевой диагностики) - Бодров Ю.Д.
- Электрохимический лизис метастазов печени под ультразвуковым контролем (возможности и перспективы) - Борсуков А.В.
- Ультразвуковая диагностика холестероза желчного пузыря - Никитина М.Н.
- Трехмерное ультразвуковое изображение абдоминальных структур - H.X. Xu


