Ультразвуковые исследования печени в педиатрии
Рубрика: Эхография в педиатрии
Введение
Заболевания печени нередко проявляются неспецифическими жалобами и в ряде случаев выявляются случайно. Это относится, прежде всего, к детям, у которых доля врожденной патологии выше, чем у взрослых. Резервные возможности печени высоки, поэтому задача врача - выявить патологию, прежде чем она станет клинически значимой.
Клиническая анатомия печени
Известно высказывание, сравнивающее ультразвуковые исследования (УЗИ) с волшебным фонариком, позволяющим заглянуть в темную комнату и рассмотреть ее содержимое. УЗИ представляют нам "живую анатомию" органа, позволяя поставить топический диагноз при очаговом поражении печени или объективно охарактеризовать динамику диффузного процесса.
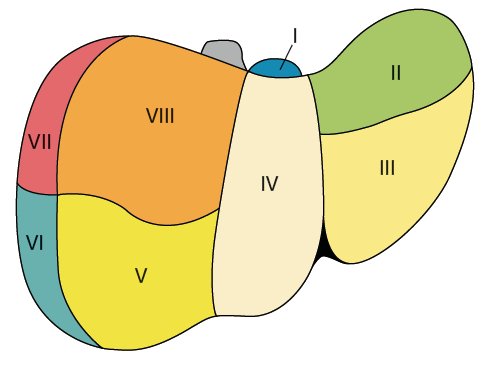
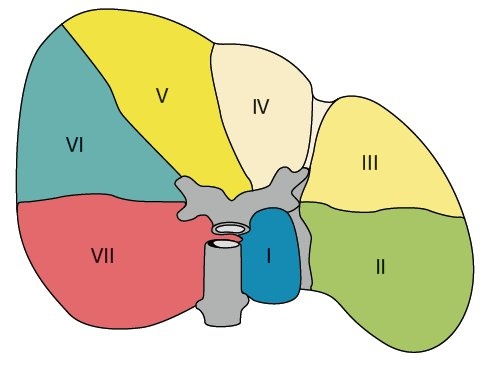
Правая и левая доли печени отделены бороздой, идущей от дна желчного пузыря к нижней полой вене. В каждой доле печени 4 сегмента: в левой доле первые четыре, в правой - с V по VIII. Сегменты выделяются на основе веточки воротной вены в их центре и печеночной вены на периферии. I сегмент (рис. 1) известен как хвостатая доля (доля Шпигеля).
а) Вид с диафрагмальной поверхности.
б) Вид с абдоминальной поверхности.
Ветви воротной вены отходят в форме, напоминающей две лежащие на боку буквы "Н", одна из которых снабжает левую долю (сегменты I-IV), другая - правую (сегменты V-VIII). "Н" левой доли лучше всего визуализируется при косом субксифоидальном доступе (рис. 2). К этой лежащей на боку "Н" прикрепляются серповидная и венозная (малый сальник = печеночно-желудочная связка) связки. Венозная связка - фиброзный остаток венозного протока, по которому у плода осуществляется сброс крови из левой пупочной в нижнюю полую вену. Венозная связка отграничивает I сегмент от II, серповидная - III от IV. I сегмент (хвостатая доля печени) располагается позади от нижней полой вены, сбоку от венозной связки и впереди левой ветви воротной вены. Особенность I сегмента - кровоснабжение правой и левой ветвями воротной вены (из-за малого диаметра плохо визуализируются при УЗИ) и дренаж непосредственно в нижнюю полую вену, минуя 3 основные большие печеночные вены. Портальная вена, снабжающая II сегмент - непосредственное продолжение левой ветви воротной вены, образует нижнюю "палочку" горизонтально расположенной "Н". Другую горизонтальную линию образуют ветви к сегментам III и IV. Сегменты II и III располагаются слева от венозной и серповидной связок. Сегмент IV, квадратная доля, располагается справа от серповидной связки и отделен от I сегмента левой ветвью воротной вены [1].
а) Левая доля печени.
б) Правая доля печени.
Правая часть воротной вены и ее ветвление к сегментам визуализируются при сагиттальном или косом среднеаксиллярном межреберном доступе. У детей и грацильных субъектов возможен субкостальный доступ. Правая ветвь воротной вены располагается косо вперед или вертикально. Ветви правой доли воротной вены, направляющиеся к сегментам, также формируют фигуру расположенной на боку буквы "Н" (рис. 2). Перемычку между ножками буквы "Н" образует правая ветвь воротной вены, ветви к сегментам V и VIII - верхнюю ножку, ветви к VI и VII сегментам расположены косо. Поэтому для визуализации VI сегмента датчик надо направлять в сторону правой почки. Средняя печеночная вена отграничивает V и VIII сегменты от IV, правая - V и VIII сегменты от VI и VII. V сегмент располагается медиальней от желчного пузыря. Правая ветвь воротной вены служит границей между V и VIII сегментами. Сегмент VIII отделен от VII правой печеной веной, от IV - средней печеночной веной. VI и VII сегменты отделяются от V и VIII правой печеночной веной. VI сегмент непосредственно прилежит к почке, его латеральной границей является грудная клетка. VII сегмент отделен от VIII правой печеночной веной, примыкая латерально к ребрам, каудально - к куполу диафрагмы.
Печеночные вены при косом субксифоидальном коронарном доступе напоминают букву "W", располагающуюся своим основанием на нижней полой вене. Левая печеночная вена является границей между II и III сегментами, средняя отграничивает IV сегмент от V и VIII, правая - V и VIII сегменты от VI и VII. При косом субксифоидальном доступе хорошо визуализируется правая печеночная вена, что позволяет отграничить поверхностный V сегмент от глубокого VIII.
Полноценное УЗИ подразумевает неукоснительную визуализацию ветвей воротной вены, их сегментарных ветвей, печеночных вен. Это позволяет диагностировать не только очаговые поражения печени, но и обнаружить тромбозы, сдавление сосудов объемным образованием или прорастанием опухоли в сосуд. Допплеровское исследование завершает диагностическую процедуру, определяя наличие и направление кровотока в сосудах. Рядом с сосудистым пучком (печеночная артерия и воротные вены) располагаются желчные ходы. Они становятся видны при блокаде оттока желчи [2].
Клинические проблемы
Желтухи новорожденных могут быть результатом паренхиматозных процессов (гепатоцеллюлярные) обструктивного характера, гемолитического и септического происхождения.
Диагноз должен быть установлен на самых ранних сроках. Если лечение обструкции желчевыведения или метаболических нарушений не начнется в течение ближайших 2 мес жизни, развивается фатальный цирроз печени. Эхография - важнейший метод диагностики причин гипербилирубинемий новорожденных. Методика позволяет ускорить дифференциальную диагностику внутри- и внепеченочной обструкции желчных протоков, включая кисты холедоха, спонтанную перфорацию желчного протока, атрезию внутрипеченочных ходов. Другие причины обструкции желчевыводящей системы (камни, опухоли, врожденный стеноз общего желчного протока) в периоде новорожденности встречаются редко. Внутрипеченочные нарушения могут быть при внутрипеченочной атрезии желчных ходов, редко - при развитии фиброзной ткани вокруг желчных ходов за счет гомозиготной мутации гена циррина CIRH1A на хромосоме 16q22. Кроме того, желтуха новорожденного может быть гепатоцеллюлярной (гепатиты вирусные, бактериальные, грибковые, паразитарные) или метаболической (непереносимость фруктозы, дефицит α1-антитрипсина, муковисцидоз). С холестазом протекают гемолиз, сердечная недостаточность, шок, сепсис, волчанка новорожденных [3, 4].
Желтуха - показание к УЗИ. Расширение внутрипеченочных протоков свидетельствует о внепеченочной обструкции желчных ходов. Если причина обструкции остается неясной, проводится чрескожная холангиоили холецистография. При условии сохранной функции гепатоцитов проходимость общего желчного протока может быть установлена и гепатобилиарной сцинтиграфией [5]. Исследования, направленные на уточнение характера выделения желчи, или сканирование желчного пузыря проводятся после 3-5 дней назначения фенобарбитала как стимулятора выделения желчи [6]. На заключительном этапе диагностики возможна биопсия печени. Эхографическим признаком билиарной атрезии является конусовидное уплотнение, визуализируемое при поперечном или продольном сканировании и распространяющееся вверх от воротной вены, особенно в сочетании с малым по размерам желчным пузырем (длинник <1,5 см) или его отсутствием [7].
Кисты желчевыводящей системы. Причиной желтухи у новорожденных и детей грудного возраста может быть и расширение общего желчного протока разной степени выраженности и локализации, известное как кисты холедоха. Кисты холедоха могут выявляться и у более старших детей. В этом случае они проявляются болями, желтухой, холангитом, очень редко - пальпируемым образованием. По мере существования кисты возможно расширение внутрипеченочных протоков или образование в ней камней. Эхографически кисты проявляются тонкостенными округлыми образованиями в области ворот печени или внутри ее паренхимы (рис. 3). Отдельно визуализируется желчный пузырь, что очень важно для дифференциальной диагностики [8]. Для точного картирования желчевыводящей системы и действительного сообщения кисты с желчными ходами перед хирургическим вмешательством проводят сцинтиграфию, чрескожную холецистохолангиографию, эндоскопическую ретроградную холецистопанкреатографию.
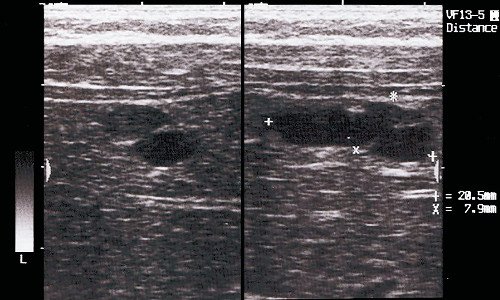
Рис. 3. Эхограмма врожденных кист печени у ребенка 3 мес.
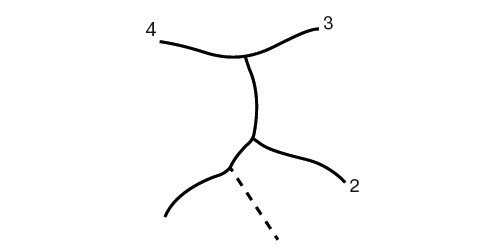
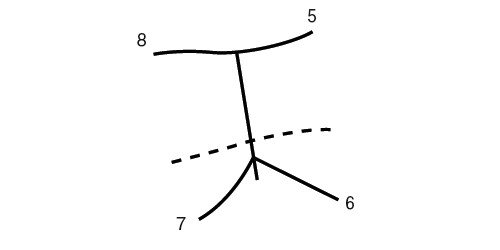
Выделяют 5 типов (рис. 4) кист желчных протоков [9]:
- I тип. Изолированная внепеченочная киста, цилиндрическое или мешотчатое расширение общего желчного протока. 80-90% всех случаев кист желчных ходов. Возможны распространение кисты в панкреатический проток с формированием общего канала в двенадцатиперстную кишку, затекание желчи в вирсунгов проток, активация ферментов поджелудочной железы с панкреонекрозом. Кисты холедоха иногда удается визуализировать уже у 15-недельных плодов, когда амилаза еще не секретируется. Удаление кисты оправдано уже у новорожденного, когда воспалительная реакция минимальна и хронический панкреатит не формируется. Киста общего желчного протока кажется более реальной причиной хронического рецидивирующего панкреатита, чем давно известная теория общего желчно-панкреатического протока. Другими вариантами расширения (кисты) общего желчного протока являются его частичная атрезия с расширением вышерасположенной части и атрезия тонкой кишки с впадением протока в ее слепую часть [10].
- II тип (2-3%) выглядит как множественные дивертикулы общего желчного протока.
- III тип (1-5%) - расширение интрадуоденального отрезка.
- IV тип (10%) - множественные вне- и внутрипеченочные кисты.
- V тип - синдром Кароли, кисты мелких внутрипеченочных протоков [11]. Нередко одно из проявлений поликистозной болезни, быстро прогрессирует фиброз. Эхографически вокруг ветвей воротной вены обнаруживаются кисты. Их отличие от вен производится по данным допплерографии (рис. 5). Возможно их нагноение и абсцедирование печени.
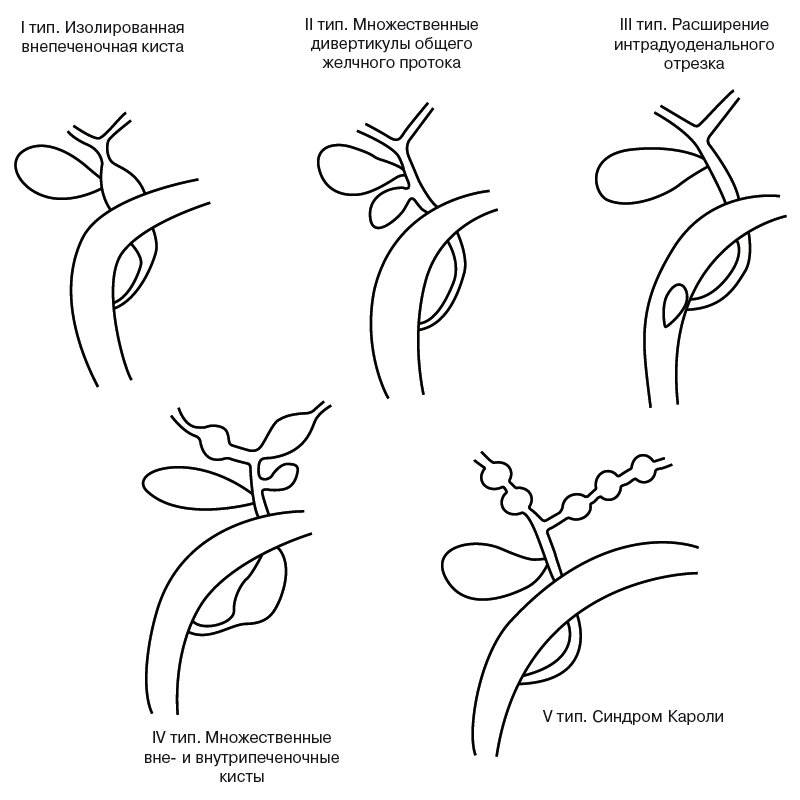
I тип - изолированная внепеченочная киста.
II тип - множественные дивертикулы общего желчного протока.
III тип - расширение интрадуоденального отрезка.
IV тип - множественные вне- и внутрипеченочные кисты.
V тип - синдром Кароли.
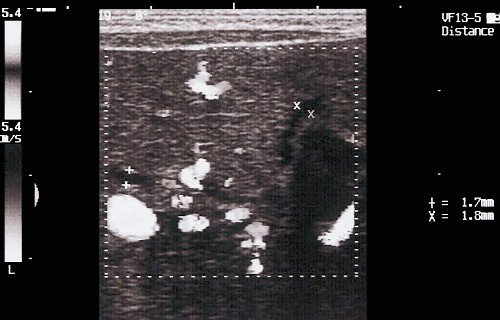
а) Допплерография печени при синдроме Кароли. Виден кровоток в венах. Одновременно визуализируются неравномерно расширенные желчные ходы (кровоток внутри не определяется), выделенные маркерами.
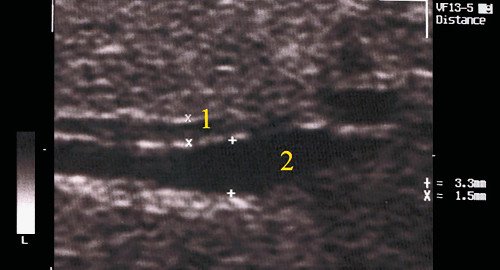
б) Эхографическое изображение неравномерно расширенного внутрипеченого протока (2) рядом с веной (1). Стенки вены более плотные.
Существуют и иные классификации, выделяющие подтипы кист, иное число типов. Но эти вариации абсолютно не принципиальны. Важны выявление кист, их локализация и ответы на вопросы об осложнениях и прогнозе.
Редко, как правило, в области соединения пузырного и общего желчного протоков, возможен спонтанный разрыв желчного протока, что клинически проявляется симптомами острого живота. Эхографически обнаруживается жидкость вокруг желчного пузыря и свободная жидкость в брюшной полости без расширения протоков.
Синдром Алажиль - уменьшение числа внутрипеченочных желчных ходов. Неоднородное состояние, передается аутосомно-доминантно с разной степенью экспрессивности (гетерозиготной мутации гена JAG1 на хромосоме 20р12 и, другой вариант, мутация гена NOTCH2). В разных сочетаниях и степени выраженности проявляется холестазом, маленьким желчным пузырем (результат задержки желчи в печени), фиброзом печени, клапанным стенозом легочной артерии, глазным гипертелоризмом, аномалиями скелета, отсутствием глубоких сухожильных рефлексов, трудностью усвоения школьной программы, дисплазией почек и т.д. Гистологически обнаруживается резкое уменьшение числа внутрипеченочных протоков. Эхографически печень увеличена, чаще за счет левой доли, возможна портальная гипертензия [12].
Атрезия внутри- или внепеченочных желчных ходов (1:10 000 живорожденных, М=Ж) - отсутствие или облитерация желчных ходов. Быстро развивается билиарный цирроз печени. У 20% пораженных сочетается с трисомией 17-й или 18-й хромосомы, полиспленией, зеркальным расположением внутренних органов, сегментарной атрезией нижней полой вены, расположением воротной вены впереди двенадцатиперстной кишки. Есть мнение о внепеченочных внешних причинах атрезии желчных ходов. В пользу этого свидетельствуют отсутствие сочетанной патологии панкреатического протока, закладывающегося одновременно с желчными ходами, крайняя редкость заболевания у плодов и мертворожденных. Высказывается мнение, что атрезия возникает после закладки желчных ходов за счет попадания внутриутробно в желчевыводящую систему инфекции с развитием воспаления и облитерации. Аналогичный эффект известен для карбамазепина. После рождения быстро, в первые 2-3 нед, нарастает желтуха. Эхографически желчный пузырь не визуализируется или его длинник меньше 1,5 см, расширение мелких внутрипеченочных протоков, визуализируется конусовидное уплотнение на месте общего желчного протока, распространяющееся от ворот печени, полиспления.
Если атрезия касается только внепеченочных протоков, остается надежда на оперативное вмешательство и создание анастомоза к двенадцатиперстной кишке. Операция должна быть проведена не позже 2 мес жизни. Полного восстановления дренажа удается достичь в 30% случаев, еще в 30% - частичного. Но даже при удачном исходе операции к 20-му году жизни у 75% оперированных развивается печеночная недостаточность, требующая трансплантации печени [13, 14]. Внутрипеченочная атрезия фатальна. Гипотетически можно говорить о трансплантации печени вместе с желчным пузырем, но у новорожденных такая операция более чем сомнительна (рис. 6).
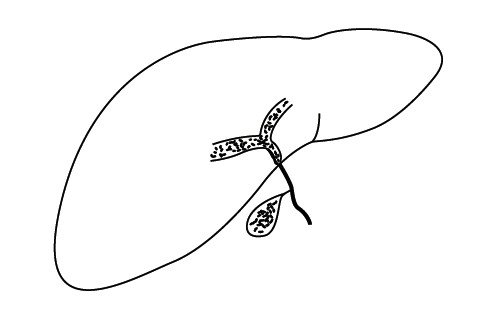
а) Внепеченочная атрезия желчных протоков.
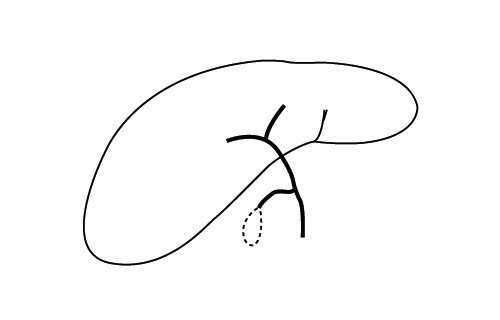
б) Тотальная атрезия желчных протоков.
Гепатит новорожденных развивается в первые 3 мес жизни. Бактерии, вирусы проникают в печень через плаценту, из влагалища, по инфицированному катетеру, при переливании крови. Трансплацентарная инфекция реализуется на последнем триместре беременности. Бактериальный гепатит вторичен по отношению к инфекции из амниотической жидкости, инфицированного эндометрия, плаценты и влагалища. При многоплодной беременности в первую очередь инфицируется плод, располагающийся ближе к шейке матки. В этом случае наиболее вероятными агентами являются листерии и кишечная палочка. При вагинальном родоразрешении возбудителями гепатита могут быть вирусы герпеса, цитомегаловирусы, вирус иммунодефицита, листерии. Гемотрансфузии могут быть причиной инфицирования вирусами гепатитов В и С, цитомегаловирусами, Эбштейна-Барр, ВИЧ. При катетеризации пупочной вены инфицированным катетером типичны бактериальный гепатит и абсцессы. УЗИ малоспецифичны и показаны для целей дифференциальной диагностики и исключения абсцесса печени. Одной из находок может быть утолщение стенок желчного пузыря (отек при гипоальбуминемии).
Сепсис, инфекция мочевых путей и неонатальные желтухи чаще сочетаются у мальчиков, чем у девочек. Чем младше ребенок, тем менее специфичны симптомы. Инфекция проявляется общей вялостью, лихорадкой, рвотой, поносами, гепатомегалией. УЗИ необходимы для уточнения состояния почек, мочевого пузыря, наддиафрагмального пространства (плевриты).
Врожденные нарушения обмена быстро приводят к повреждению печени. В настоящее время многие из них благополучно лечатся исключением определенных продуктов, заместительной диетой, ферментами или лекарственными препаратами. Поэтому педиатры и специалисты визуальной диагностики должны быть хорошо знакомы с проявлениями врожденных нарушений обмена. Гепатопатии, сопровождающие врожденные нарушения обмена, возникают в результате накопления токсинов при блокаде естественного метаболизма или отсутствия ферментов, способствующих разрушению метаболизируемых в печени токсинов. При различных вариантах нарушения обмена этапы поражения печени могут варьировать. Например, максимально выраженное поражение гепатоцитов наблюдается при гликогенозе IV типа, галактоземии, непереносимости фруктозы, тирозинемии, болезни Вильсона, менее выражен цитотоксический эффект при гликогенозах I и III типов, дефиците α1-антитрипсина. Длительно сохраняется функция гепатоцитов при болезни Гоше, мукополисахаридозе. При гликогенозе, галактоземии, тирозинемии и муковисцидозе превалируют признаки стеатоза. Максимальный риск гепатоцеллюлярной карциномы известен при дефиците α1-антитрипсина, тирозинемии, гликогенозе I типа. Аденома печени типична для тубулопатий с ацидозом и нефрокальцинозом. Наилучшим методом лечения тирозинемии является трансплантация. Лекарственная терапия показана при лечении острых неврологических кризов при тирозинемии. Абсолютным показанием к трансплантации печени является появление внутрипеченочных узлов, так как гепатокарцинома развивается у 30% детей, переживших период новорожденности. Нет абсолютных эхографических признаков, позволяющих достоверно разграничить узлы регенерации от аденомы или карциномы [15]. УЗИ при подозрении на метаболические поражения печени должны включать не только оценку размеров и архитектоники печени (стеатоз, цирроз, узлы регенерации), но и допплерографию для исключения портальной гипертензии, а также состояние почек (размеры, состояние паренхимы).
Жировая дегенерация (инфильтрация) печени (стеатоз). Жир накапливается в гепатоцитах после их повреждения (жировая дегенерация), при избыточном поступлении жира (инфильтрация) или при дефиците ферментов, мобилизующих жир из печени. К жировой дегенерации печени приводят многие препараты (ацетилсалициловая кислота, вальпроаты, варфарин, тетрациклин), токсины (афлотоксин) и алкоголь. Стеатоз свойственен нарушениям метаболизма (галактоземия, непереносимость фруктозы), ожирению, наследственным и приобретенным синдромам гиперлипидемии, сахарному диабету. При многих заболеваниях развитие стеатоза обусловлено несколькими механизмами, например, при нефротическом синдроме сочетается нарушение выведения жира из печени с его усиленным поступлением в гепатоциты. В случаях парентерального питания при отсутствии липидов стеатоз развивается в результате дефицита ненасыщенных жирных кислот. Стеатоз до определенного предела обратим. УЗИ позволяют диагностировать стеатоз на субклиническом уровне. Эхографически стеатоз проявляется повышением акустической плотности печени, приближающейся к плотности стенок сосудов. Эхогенность коркового вещества почек значительно ниже. Локальный (очаговый) стеатоз выглядит как внутрипеченочные округлые или продолговатые образования с достаточно ровными контурами. По контрасту с ними неизмененные участки печени кажутся гипоэхогенными. Повышенная эхогенность стеатозной печени может маскировать метастазы и абсцессы, поэтому при подозрении на стеатоз печени требуется компьютерная томография. Окончательная верификация очаговых изменений (например, метастазов) на фоне стеатоза возможна только по результатам прицельной биопсии [16]. При жировой инфильтрации печени менее всего и позже всего страдают IV и V сегменты. Это объясняется их кровоснабжением по ветвям пузырной артерии [17].
Цирроз печени у детей, как правило, постнекротический или билиарный. Морфологически цирроз выглядит как узлы регенерации, лишенные центральных вен, окруженные полями соединительной ткани. Естественная архитектоника печени оказывается измененной, нарушается циркуляция крови, возникает портальная гипертензия. Эхографически (рис. 7) возрастает акустическая плотность печени, четко прослеживается аттенуация ультразвука, для визуализации паренхимы печени требуются низкочастотные трансдьюсеры (2,5-3 МГц). Эхографическая картина зависит от степени выраженности цирроза. Вначале паренхима предстает крупнозернистой, по мере прогрессирования цирроза поверхность печени становится бугристой за счет крупных очагов регенерации, хвостатая доля (I сегмент печени) увеличивается в размерах, появляется жидкость в брюшной полости.
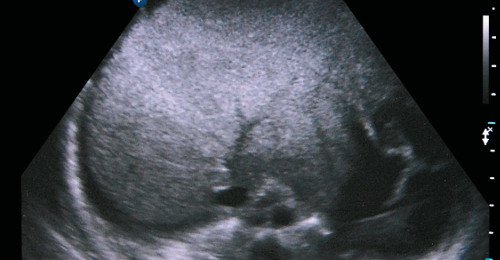
Рис. 7. Эхографическая картина цирроза печени. Печень существенно неоднородно уплотнена, сосудистый рисунок деформирован, окружена ободком асцитической жидкости.
Опухоли печени могут достигать больших размеров при минимальной клинической картине. Злокачественные опухоли печени в большинстве случаев происходят из эпителия [18]. Гепатобластома, самая частая первичная опухоль печени у детей первых 3 лет жизни, рассматривается как инфантильный вариант гепатоцеллюлярной карциномы. Гепатобластома сочетается с синдромами Видемана-Беквита, гемигипертрофии, Гольденхара, Симпсона-Голаби-Бемеля, Сотоса, трисомии 20-й хромосомы, тетрадой Фалло, дивертикулом Меккеля, внепеченочной атрезией желчных ходов. Концентрация сывороточного α-фетопротеина повышена до 100 000- 300 000 мкг/мл. Иногда опухоль секретирует гонадотропин, что проявляется преждевременным половым созреванием. Эхографически опухоль обычно выглядит как солидный неоднородной плотности большой узел с плохо очерченными краями, мелкими кистами (рис. 8) и округлыми или неправильной формы отложениями кальция. Этот тип кальцификации отличается от кальцификации гемангиоэндотелиом: нежные линейные депозиты [19]. Внутрипеченочные сосуды оттесняются новообразованием и "ампутируются" им. Значительно реже, чем при гепатоцеллюлярной карциноме, встречаются внутрисосудистые тромбы. Допплерография позволяет уточнить степень инвазии сосудов и кровоток внутри опухоли. Прогноз определяется числом пораженных сегментов и степенью вовлеченности сосудов, что наилучшим образом определяется по результатам МРТ.
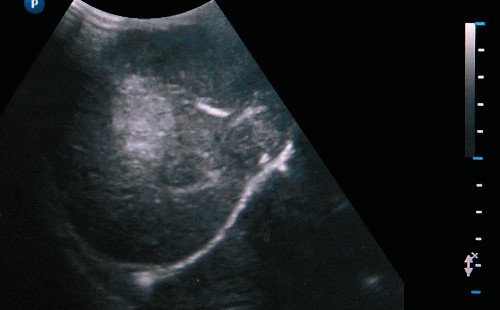
Рис. 8. Эхографическое изображение опухоли печени (стрелка).
Гепатоцеллюлярная карцинома, вторая по частоте злокачественная опухоль. Максимальная заболеваемость - в возрасте 4-5 и 12-14 лет. У 50% заболевших опухоль развивается на фоне гликогеноза I типа, тирозинемии, дефицита α1-антитрипсина, постгепатитного или билиарного цирроза, синдрома Алажиль. Концентрация сывороточного α-фето про теина повышена. По результатам УЗИ обнаруживаются очаги неоднородной эхогенности, кальцификация встречается редко. Опухоль быстро прорастает в портальные вены. Патологический ангионеогенез в гепатоцеллюлярной карциноме, точно так же, как и в гепатобластоме, проявляется сетью мелких сосудов на периферии опухоли. Гладкомышечных волокон в стенке этих сосудов нет, по данным допплерографии периферическое сопротивление незначительное, кровоток стремительный, его скорость превосходит аортальную [20].
Недифференцированная эмбриональная саркома (злокачественная мезенхимома) - злокачественный вариант гамартомы. Встречается редко, преимущественно у детей 6-10 лет. Быстро прогрессирует с появлением центральных некрозов и кист. Концентрация сывороточного α-фето про теи на не изменена. Эхографически обнаруживается большое гетерогенное образование.
Билиарная рабдомиосаркома, редкий вариант первичной рабдомиосаркомы, исходит из желчевыводящих путей. Средний возраст заболевших 3-4 года. Клинически проявляется дистрофией, болями в животе, увеличением его в объеме, гепатомегалией, интермиттирующей обструктивной желтухой. Наилучшим образом визуализируется при локализации внутри общего желчного протока. По данным УЗИ - неоднородной плотности, вышерасположенные желчные протоки расширены. Метастазирует в легкие и кости.
Метастазы в печени типичны для опухоли Вильмса, нейробластомы, лимфом и лейкозов [21].
Чуть меньше половины (40%) всех первичных опухолей печени у детей - доброкачественные. До 60% всех доброкачественных опухолей приходится на гемангиомы, мезенхимальную гамарому, аденомы и фокальную узловую гиперплазию [22].
Гемангиомы - сосудисто-мезенхимальные образования, характеризующиеся интенсивным несовершенным ангиогенезом, нередко множественные в различных органах и на коже. Возникающее артериовенозное соустье может привести к сердечной недостаточности, тромбоцитопении потребления. Инфантильная гемангиоэндотелиома эхографически выглядит как солидные массы, в ряде случаев распространенные, различной эхогенности, иногда с нежными линейными фокусами кальцификации [23, 24]. Допплерографически выявляется интенсивный кровоток в извитых беспорядочно расположенных сосудах (рис. 9). При массивном артериовенозном сбросе нижерасположенная аорта уменьшена в диаметре, расширены чревный ствол, печеночная артерия и вены. Наряду с эмболизацией широко применяется лечение пропранололом [25]. Солитарная кавернозная гемангиома растет медленно и, как правило, чаще встречается у взрослых.
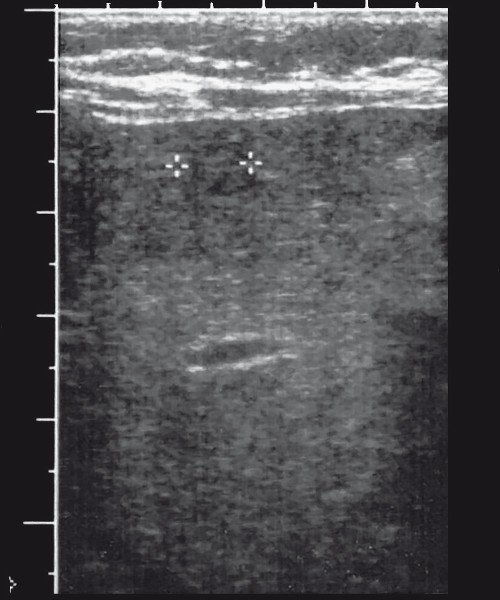
а) эхографически на фоне неоднородной по плотности паренхимы визуализируется мелкое кистозное многокамерное образование (выделено маркерами).
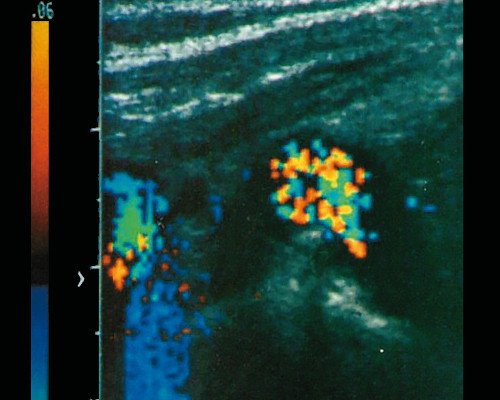
б) при допплерографии хорошо прослеживается беспорядочный вихреобразный кровоток.
Мезенхимальная гамартома - редкое поликистозное образование, исходящее из перипортальной мезенхимы. Обнару живает ся чаще у детей первых 2 лет жизни в правой доле печени при случайных обследованиях [26].
Аденомы печени, если они не ассоциируются с гликогенозом I типа, приемом оральных контрацептивов, стероидной терапией при анемии Фанкони, крайне редки. Сывороточная концентрация α-фетопротеина не изменяется. Эхографические признаки аденомы неспецифичны, плотность может быть гипер- или гипоэхогенной. Дифференциальная диагностика аденомы от злокачественного новообразования возможна только по результатам прицельной биопсии.
Абсцессы печени у предварительно здорового ребенка маловероятны. Они формируются при первичных иммунодефицитах (например, хроническая гранулематозная болезнь), депрессия иммунитета на фоне химиотерапии, при сепсисе, холангите, аппендиците. Эхографически зрелый абсцесс выглядит как хорошо ограниченное жидкостное образование, возможно, недостаточно однородное за счет детрита или сгущения гноя. Сосуды смещены, но не инвазированы. Множественные мелкие абсцессы типичны для иммунодефицитов. Для них типична кальцификация при успешном лечении. В диагностике мелких абсцессов более информативны КТ или МРТ высокого разрешения [27].
Паразитарные абсцессы, прежде всего, осложнение амебиаза. Амебиаз - эндемичное тропическое заболевание, но в связи с миграцией населения может проявиться в любом географическом регионе. Передается от человека к человеку при нарушении гигиенических правил. Entamoeba histo lytica, попадая в пищеварительную систему, задерживается в толстой кишке, проникает в слизистую и оттуда по венам брыжейки через портальную систему транспортируется в печень. E. histolytica продуцирует протеолитические ферменты, что приводит к быстрому абсцедированию. Множественные абсцессы печени - самое частое внекишечное осложнение этой инфекции, проявляющееся гепатомегалией и высокой лихорадкой без желтухи [28]. Никаких специфичных эхографических признаков амебных абсцессов нет. Заболевание осложняется распространением в брюшную полость, подпеченочное пространство, соседние органы.
Эхинококкоз печени выглядит как кистозное четко ограниченное образование (рис. 10) с видимой стенкой и нежным эхонегативным ободком [29, 30]. Внутри эхинококкового пузыря могут визуализироваться мелкие эхопозитивные структуры (сколлексы). Предпочтительная локализация эхинококкового пузыря в печени не случайна. Печень, будучи важнейшим депо гликогена, сама его не потребляет, а живет за счет пентозного цикла. Именно из пятичленных сахаров (пентозы) построена внешняя оболочка гидатидного пузыря, оберегающая его от иммунной системы человека. Таким образом, паразит выбирает наиболее оптимальное место для своего развития. После гибели паразита на фоне лечения или после удаления пузыря остается соединительнотканный рубец.
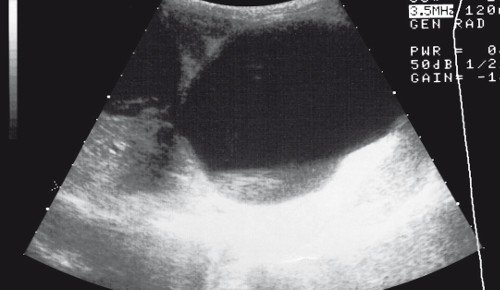
Рис. 10. Множественный эхинококкоз печени.
Гранулемы печени при УЗИ выглядят как округлые эхопозитивные образования и могут быть бактериальными (микобактериоз, листериоз, спирохетоз), грибковыми (кандидоз, аспергиллез).
Литература
- Majno P., Mentha G., Toso Ch. et al. Anatomy of the liver: an outline with three levels of complexity - a furthe step towords tailorad territorial resection // J Hepatol. 2014; 60 (3): 654-662.
- Chamberlain R. Essential functionel hepatic and biliary anatomy for surgeon. 2013. http://dx.doi.org/10.5772/53849
- Pawlowska J., Jankowska I., Gliwicz D. et al. Rare hereditary intrahepatic cholestatic syndromes in children // Exp Clin Hepatol. 2010; 6 (2): 23-26.
- Santos J., Choquette M., Bezerra J. Cholestatic liver disease in children // Curr Gastroenterol. 2010; 12 (1): 30-39.
- O'Hara S. Pediatric liver and spleen. In: Carol R. (ed.). Diagnostic Ultrasound. Fouth Edition. Mosby, 2011: 1800-1044.
- Ikeda S., Sera Y., Yamamoto H. et al. Effect of phenobarbital on serial ultrasonic examination in the evaluation of neonatal jaundice // Clin Imaging. 1994; 18 (2): 146-148.
- Kendrick A., Phua K., Ooi B. et al. Making the diagnosis of biliary atresia using the triangular cord sign and gallbladder length // Pediatr Radiol. 2000; 30 (2): 69-73.
- Gupta N., Javed A., Puris S. et al. Imaging of multiple intrahepatic cysts // Oman Med J. 2012; 27 (5): 421-423.
- Todani T., Watanabe Y., Narusue M. et al. Congenital bile duct cysts: classification, operative procedures, and review of thirty-seven cases // Am J Surg. 1977; 143 (2): 263-269.
- McHugh K., Daneman A. Multiple gastrointestinal atresias: sonography of associated biliary abnormalities // Pediatr Radiol. 1991; 21: 355-357.
- Senyuz O., Yesildag E., Kuruoglu S. et al. Carolis disease in children: is it common misdiagnosed? // Acta Pediatr. 2005; 94 (1): 117-120.
- Zissimopoulus A., Cassimos D., Deftereous S. et al. Hepatobiliary scan in Alagille syndrome: arteriohepatic dysplasia // Hell J Nucl Med. 2009; 12 (2): 158-160.
- Kasai M., Suzuki H., Ohashi E. et al. Technique and results of operative management of biliary atresia // World J Surg. 1978; 2 (5): 571-579.
- Bezerra J., Balistreri W. Cholestatic syndromes of infancy and childhood // Semin Gastrointest Dis. 2001; 12 (2): 54-65.
- Dubois J., Garel L., Patriquin H. et al. Imaging features of type 1 hereditary tyrosinemia: a review of 30 patients // Pediatr Radiol. 1996; 26 (12): 845-851.
- Ozcan N., Oguz B., Hallilooglu M. et al. Imaging patterns of fatty liver in pediatric patients // Diagnostic Intervent. Radiol. 2014; 21 (4): 355-360.
- Aubin B., Denys A., Lafortune M. et al. Focal sparing of liver parenchyma in steatosis: role of the gallbladder and its vessels // J Ultrasound Med. 1995; 14 (2): 77-80.
- Dachman A., Pakter R., Ros P. et al. Hepa toblastoma: radiologic-pathologic correlation in 50 cases // Radiology. 1987; 164 (1): 15-19.
- Campenhout Van I., Patriquin H. Malignant microvasculature in abdominal tumors in children: detection with Doppler sonography // Radiology. 1992; 183 (2): 445-448.
- Meyers R. Tumors of the liver in children // Surg Oncol. 2007; 16 (3): 195-203.
- Fernandes-Pinedal I., Cabello-Laureano R. Differen tial diagnosius and management of liver tumors in infants // World J Hepatol. 2014; 6 (7): 486-495.
- Isaacs Jr. Fetal and neonatal hepatic tumors // J Pediatr Surg. 2007; 42 (11): 1797-1803.
- Kassarjian A., Zurakowsky D., Dubois J. et al. Infantile hepatic hemangiomas: clinical and imaging findings and the correlation with therapy // Am J Roentgenol. 2004; 182 (3): 785-795.
- Dachman A., Lichtenstein J., Friedman A., Hartman D. Infantile hemangioendothelioma of the liver: a radiologic-pathologic-clinical correlation // Am J Roentgenol. 1983; 140 (6): 1091-1096.
- Cavalli R., Novotna V., Boffun R., Gelletti C. Multiple cutaneous and hepatic infantile hemangiomas having a successful respons to propronalole as monotherapy at neonatal period // G Ital Dermatol Venerol. 2013; 148 (5): 525-530.
- Ross P., Goodman Z., Ishak K. et al. Mesenchymal hamartoma of the liver: radiologic-pathologic correlation // Radiology. 1986; 158 (3): 619-624.
- Salahi R., Dehghani S., Salahi S. et al. Liver abcesses in children: a 10-ear single centre experience // Saudi J Gastroenterol. 2011; 17 (3): 199-202.
- Stanley S. Amoebiasis // Lancet. 2003; 361 (9362): 1025-1034.
- Czermak B., Akhan O., Hiemetzberger R. et al. Echinococcus of the liver // Abdominal Imaging. 2008; 33 (2): 133-143.
- Macpherson C., Bartholomot B., Frider B. Applica tion of ultrasound in diagnosis, treatment, epide mi ology, public health and control of Echino coccus granulosis and E. multilocularis // Pa ra si tolo gy. 2007; 127 Suppl: S21-35.
УЗ сканер Samsung RS85
Аппарат премиум класса со встроенным искусственным интеллектом, для лечебных учреждений с высокими требованиями к ультразвуковой диагностике.
Публикации по теме
- Рабдомиома сердца - Делягин В.М.
- УЗИ мышц в отдаленный период после лечения онкологических заболеваний у детей и подростков - Делягин В.М.
- Ультразвуковые исследования печени в педиатрии - Делягин В.М.
- Оценка нормативных значений размера правого предсердия в детском и подростковом возрасте на примере большой группы здоровых детей в Северо-Западном регионе РФ: эхокардиографическое исследование - Цоколов А.В.
- Ультразвуковое исследование мышц в норме и при нейромышечной патологии - Делягин В.М.


