Ультразвуковая диагностика глубокой инвазии плаценты (PAS 3b)
Рубрика: Эхография в акушерстве
УЗ сканер Samsung RS85
Аппарат премиум класса со встроенным искусственным интеллектом, для лечебных учреждений с высокими требованиями к ультразвуковой диагностике.
Введение
За последние 40 лет частота операций кесарева сечения выросла более чем на 20% при одновременном 10-кратном росте частоты врастания плаценты [1]. Термин «врастание плаценты» известен миру с 1937 г., когда впервые C. Irving и A.T. Hertig определили его как «аномальное частичное или полное прикрепление последа к стенке матки» [2]. Однако приоритетная «пальма первенства» в описании данной аномалии плацентации все-таки принадлежит канадскому специалисту D.S. Forster, который в 1927 г. первым опубликовал в PubMed случай placenta accreta [3].
За прошедшие десятилетия радикально изменился алгоритм постановки диагноза «врастание (приращение)» плаценты. Во времена D.S. Forster, C. Irvinga и A.T. Herting патология идентифицировалась исключительно по факту осложненного течения последового (затруднения вплоть до невозможности отделения плаценты, сопровождаемые профузным маточным кровотечением) или послеродового периода (весьма обильное маточное кровотечение). В настоящее время основным методом диагностики врастания плаценты является эхография (ультразвуковое сканирование) [4, 5].
Пересмотрены варианты терминологии и классификации данной патологии. В настоящее время во всем мире внедрена новая и весьма точная терминология (расстройства спектра приращения плаценты (placenta accrete spectrum, PAS)), охватывающая весь спектр аномальных расстройств плацентации: аномально адгезивную плаценту (placenta accrete) и аномально инвазивную плаценту (AIP – abnormally invasive placenta, включая placenta accreta + increta + percreta) [6].
Долгие годы широко применялась традиционная классификация PAS (в зависимости от глубины инвазии ворсин в миометрий) [7]:
- placenta accreta – частичное плотное прикрепление, при котором ворсины хориона достигают миометрия, не повреждая целостности мышечных волокон;
- placenta increta – истинное врастание ворсин в толщу миометрия; сопровождается повреждением его структуры;
- placenta percreta – ассоциируется с прорастанием ворсинами всей толщины миометрия, вплоть до параметрия и брюшины, реже соседних органов (мочевой пузырь, кишечник).
На сегодняшний день в качестве «окончательного» варианта классификации PAS предложена версия Международной федерации гинекологии и акушерства (FIGO) [6], включающая в себя следующие варианты:
- PAS 1 – аномальное прикрепление плаценты (placenta adherent or creta);
- PAS 2 – аномальная инвазия плаценты (increta);
- PAS 3 – аномальная инвазия плаценты (percreta):
3a – прорастание ограничено серозой;
3b – с инвазией мочевого пузыря;
3c – инвазия других тканей / органов малого таза.
По данным систематического обзора и метаанализа F. D'Antonio и соавт. ультразвуковых исследований у 3070 беременных с риском PAS, чувствительность УЗИ составила 90,72% (95% ДИ 87,2–93,6), специфичность 96,94% (95% ДИ 96,3–97,5) [8].
Несмотря на разработанные классификацию и алгоритмы ведения беременности и родов при различных вариантах аномального прикрепления плаценты, вопросы диагностики продолжают обсуждаться. Так, по мнению E. Jauniaux и соавт. [7], до сих пор не обнаружено ни одного ультразвукового признака или комбинации признаков, специфичных для определения глубины инвазии плаценты. Для решения данной проблемы в настоящее время широкое применение нашла магнитно-резонансная томография (МРТ). Технология МРТ рассматривается в качестве полезного инструмента для оценки глубины инвазии при подозрении на placenta percreta, а также в диагностике сложных случаев, таких как преимущественное расположение предлежащей плаценты по задней стенке матки [9, 10].
Учитывая существующие сложности в антенатальной верификации глубокой инвазии плаценты, представляем собственный клинический опыт диагностики подобной аномальной плацентации.
Клиническое наблюдение
Повторнородящая Д., 35 лет. В анамнезе двое оперативных родов (кесарево сечение в 2014 и 2017 гг.). Соматический анамнез отягощен хроническим пиелонефритом, мочекаменной болезнью.
При настоящей беременности пациентка проходила скрининговые ультразвуковые исследования в 12, 20 нед на оборудовании среднего и экспертного класса. В 12 нед обнаружено, что «…хорион достигает области внутреннего зева, отмечается повышенная васкуляризация миометрия области перешейка передней стенки». Констатировано, что пациентка угрожаемая по аномалиям плацентации.
В сроке 21 нед при скрининговом осмотре (УЗ сканер WS80A компании Samsung) описано полное предлежание плаценты, «толщина области послеоперационного рубца 3,2 мм; справа миометрий области рубца не определяется, базальный слой не визуализируется, расширенные лакунарные пространства, гиперваскуляризация плаценты». Констатированы эхографические признаки врастания плаценты в послеоперационный рубец.
В сроке 23 нед эхография проводилась в условиях КОВИД-моногоспиталя в палате реанимационного отделения в соответствии с руководящими принципами и рекомендациями по оптимальной защите для снижения риска передачи вируса между оператором УЗИ и пациентом [11] с использованием портативного переносного сканера. В сроках 21–23 нед пациентка переболела новой короновирусной инфекцией СOVID-19 в тяжелой форме, осложненной двусторонней полисегментарной пневмонией (КТ-2), ДН 2. Факт аномальной плацентации был подтвержден. Констатирован вариант врастания плаценты по классификации FIGO – PAS 2.
В 28+6 нед беременности (рис. 1–3) при трансвагинальном сканировании выявлено прорастание плаценты в верхнюю треть шейки матки и цервикальный канал (PAS 3a).
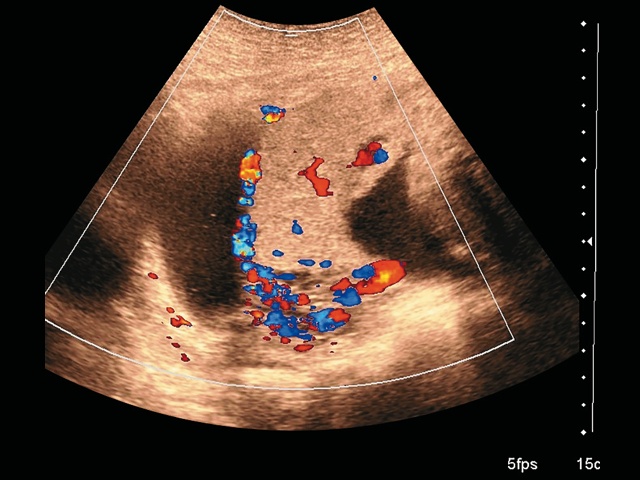
Рис. 1. Беременность 28+6 нед. Ретроплацентарные лакуны, отсутствие нормальной гипоэхогенной ретроплацентарной зоны, истончение миометрия, гиперваскуляризация пузырно-маточной зоны. Режим ЦДК.
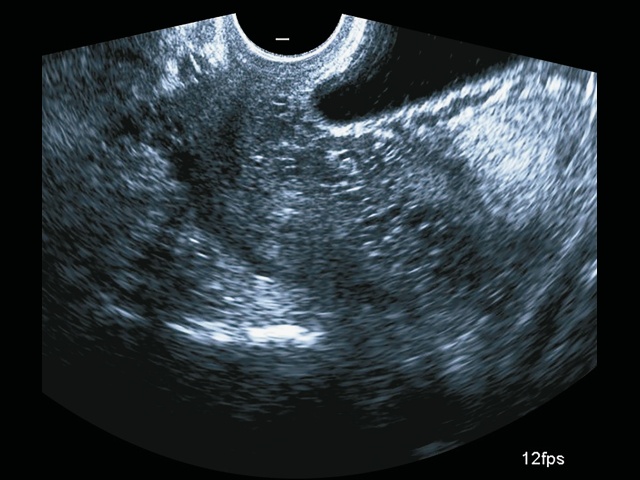
Рис. 2. Беременность 28+6 нед. Ретроплацентарные лакуны в шейке матки. Режим 2D.
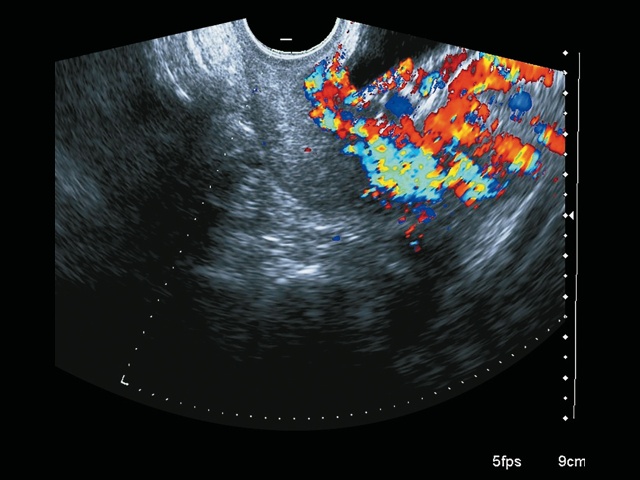
Рис. 3. Беременность 28+6 нед. Васкулярная инвазия в шейку матки. Режим ЦДК.
Сканирование в сроке 32+4 нед беременности проводилось на ультразвуковом сканере премиум-класса W10 (компании Samsung) c использованием конвексного (CA1-7A) и внутриполостного (EV3-10B) датчиков с применением технологии LumiFlow™ (рис. 4–7).
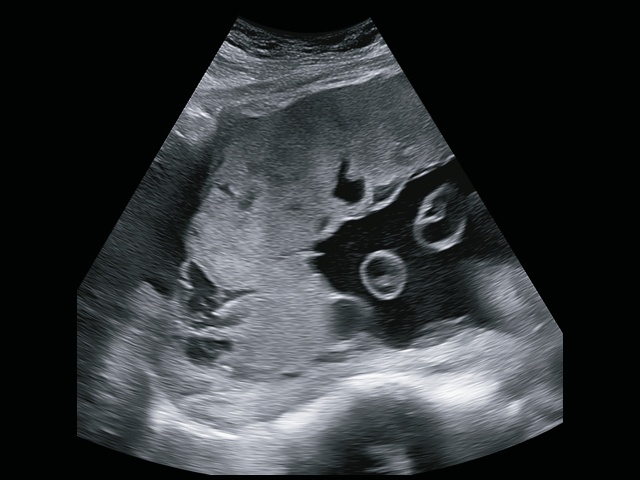
Рис. 4. Беременность 32+4 нед. Ретроплацентарные лакуны, отсутствие нормальной гипоэхогенной ретроплацентарной зоны, истончение миометрия, выпячивание плаценты.
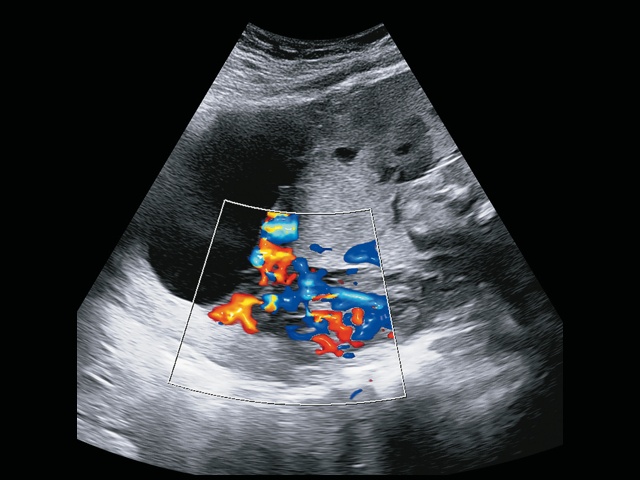
Рис. 5. Беременность 32+4 нед. Ретроплацентарные лакуны, отсутствие нормальной гипоэхогенной ретроплацентарной зоны, истончение миометрия, гиперваскуляризация пузырно-маточной зоны. Режим ЦДК.
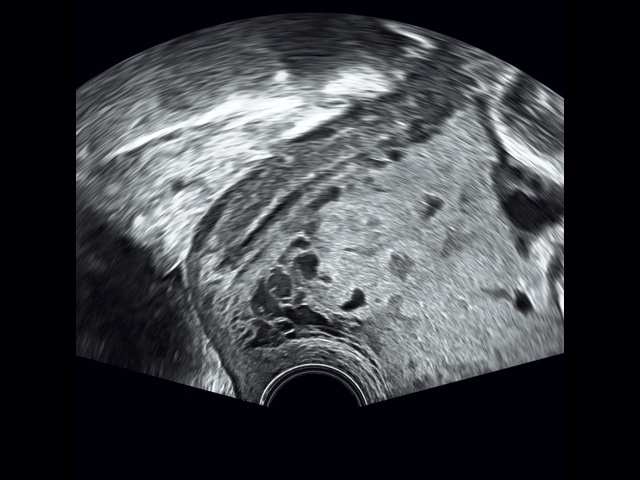
Рис. 6. Беременность 32+4 нед. Трансвагинальное сканирование: ретроплацентарные лакуны в шейке матки и цервикальном канале.
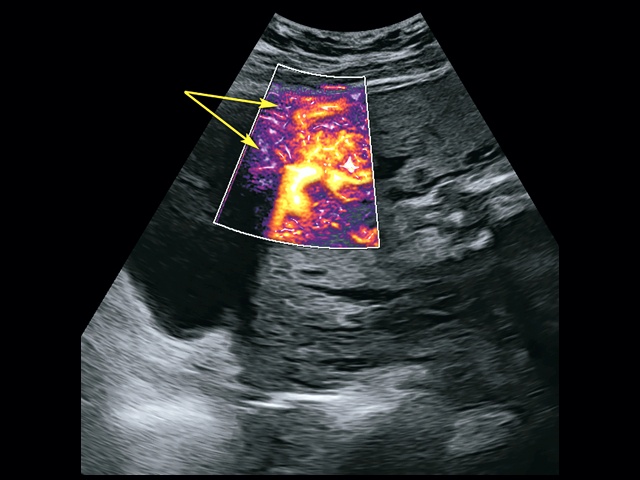
Рис. 7. Беременность 32+4 нед. Режим LumiFlow™: сосудистые мостики (rail sign) из миометрия сквозь серозный покров в стенку мочевого пузыря (стрелки).
В режиме серошкального сканирования все ранее идентифицированные особенности плацентации (PAS 3a): ретроплацентарные лакуны, васкулярная инвазия в шейку матки, исчезновение нормальной гипоэхогенной ретроплацентарной зоны, истончение миометрия, выпячивание плаценты, гиперваскуляризация пузырно-маточной зоны были подтверждены.
Дополнительное использование технологии стереоскопической визуализации кровотока (LumiFlow™) позволило визуализировать вовлеченность стенки мочевого пузыря беременной в конгломерат тканей аномальной плацентации (сосудистые мостики (rail sign) из миометрия сквозь серозный покров в стенку мочевого пузыря), то есть идентифицировать placenta percreta (PAS 3b). Проведенная в последующем МРТ констатировала полное предлежание плаценты с прорастанием в рубец, через все слои миометрия, шейку матки и цервикальный канал (рис. 8) и верхнюю стенку мочевого пузыря.
Учитывая определенную в итоге степень врастания плаценты как PAS 3b, беременность была завершена в сроке 36+6 нед плановым родоразрешением. Была выполнена нижнесрединная лапаротомия с последующим донным кесаревым сечением, перевязкой внутренних подвздошных артерий, экстирпацией матки без придатков. В ходе операции при сепарации мочевого пузыря произошло его сквозное ранение с последующим послойным ушиванием. Особенности плацентации (глубокое прорастание с инвазией в мочевой пузырь и шейку матки), описанные при УЗИ, были верифицированы интраоперационно (рис. 9) и при последующем патологоанатомическом исследовании матки.
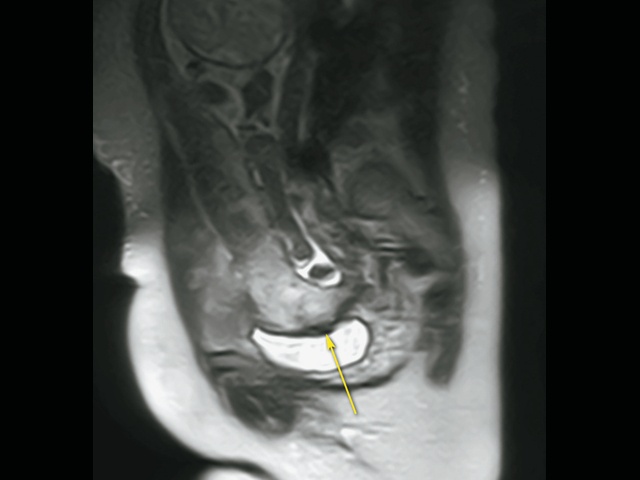
Рис. 8. Беременность 32+4 нед. МРТ – Placenta percreta (PAS 3b). Зона прорастания плаценты в рубец через все слои миометрия в верхнюю стенку мочевого пузыря (стрелка).
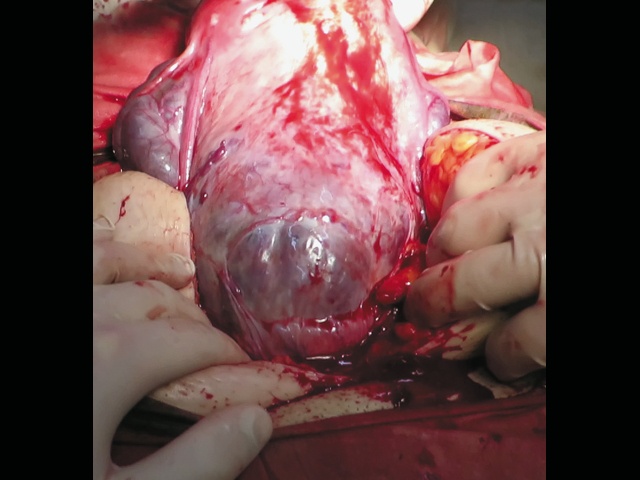
Рис. 9. Placenta percreta (PAS 3b): интраоперационный вид.
Таким образом, мнение E. Jauniaux и соавт., высказанное 6 лет назад [7], об отсутствии ультразвуковых признаков или их комбинации, специфичных для определения глубины инвазии плаценты, с внедрением в повседневную практику современных ультразвуковых технологий, LumiFlow™ в частности, может быть пересмотрено. Стереоскопическая визуализация кровотока, помогающая интуитивному пониманию структуры кровотока в мелких сосудах, является реальным инструментом в оценке степеней аномальной инвазии плаценты.
Литература
- Sokheim K.N., Esakoff T.F., Little S.E. et al. The effect of cesarean delivery rates on the future incidence of placenta previa, placenta accreta, and maternal mortality // J Matern Fetal Neonatal. Med. 2011; 24 (11): 1341–1346.
- Irving C., Hertig A.T. A study of placenta accreta // Surg Gynecol Obstet. 1937; 64: 178–200.
- Forster D.S. A case of placenta accreta // Can Med Assoc. J. 1927; 17: 204–207.
- Jauniaux E., Bhide A. Prenatal ultrasound diagnosis and outcome of placenta previa accreta after cesarean delivery: a systematic review and meta-analysis // Am J Obstet Gynecol. 2017; 217 (1): 27–36.
- Jauniaux E., Ayres-de-Campos D., Langhoff-Ross J. et al. FIGO classification for the clinical diagnosis of placenta accreta spectrum disorders // Int J Gynecol Obstet. 2019; 146 (1): 20–24.
- Morlando M., Collins S. Placenta Accreta Spectrum disorders: challenges, risks and management strategies // Int J Womens Health. 2020; 12: 1033–1045.
- Jauniaux E., Collins S.L., Jurkovic D., Burton G.J. Accreta placentation: a systematic review of prenatal ultrasound imaging and grading of villous invasiveness // Am J Obstet Gynecol. 2016; 215 (6): 712–721.
- D'Antonio F., Iacovella C., Bhide A. Prenatal identification of invasive placentation using ultrasound: systematic review and meta-analysis // Ultrasound Obstet Gynecol. 2013; 42 (5): 509–517.
- American College of Obstetricians and Gynecologists; Society for Maternal-Fetal Medicine. Obstetric care consensus. № 7. Summary: placenta accrete spectrum // Obstet Gynecol. 2018; 132 (6): 259–275.
- Jauniaux E., Alfirevic Z., Bhide A.G. et al. Placenta praevia and placenta accreta: diagnosis and management. Green-top Guideline № 27a. // BJOG. 2019; 126 (1): 1–48.
- Stephens A.J., Barton J.R., Bentum N.A. et al. General guidelines in the management of an obstetrical patient on the labor and delivery unit during the COVID-19 pandemic // Am J Perinatol. 2020; 37 (8): 829–836.

УЗ сканер Samsung RS85
Аппарат премиум класса со встроенным искусственным интеллектом, для лечебных учреждений с высокими требованиями к ультразвуковой диагностике.
Публикации по теме
- Особенности визуальной картины при различных молекулярных подтипах рака молочной железы у молодых пациенток: клинические наблюдения - Васильченко С.А.
- Ультразвуковая диагностика аномального прикрепления плаценты в I триместре беременности - Андрусенко И.В.
- Ультразвуковая диагностика глубокой инвазии плаценты (PAS 3b) - Волков А.Е.
- Аномальная форма сосудистых сплетений боковых желудочков – новый ультразвуковой маркер открытых дефектов позвоночника плода в I триместре - Эсетов М.А.
- Пренатальная диагностика аневризмы вены пуповины: клиническое наблюдение с благоприятным исходом - Волков А.Е.


