Ультразвуковая диагностика аномального прикрепления плаценты в I триместре беременности
Рубрика: Эхография в акушерстве
УЗИ сканер Samsung W10
Аппарат экспертного/премиум класса поможет расширить возможности диагностики, благодаря интуитивно понятным алгоритмам обработки и точным инструментам анализа.
Введение
Многократно возросшая за последние десятилетия частота оперативного абдоминального родоразрешения привела к десятикратному увеличению частоты встречаемости аномального прикрепления (врастания, приращения, placenta accreta spectrum (PAS)) плаценты [1]. Это, образно говоря, «одна сторона медали».
Известно, что под термином «PAS» рассматривается патологическое состояние, предполагающее прорастание (приращение) ворсин хориона (плаценты) мышечного слоя матки при полном или частичном отсутствии децидуальной оболочки (decidua basalis) [2].
В настоящее время основным методом диагностики PAS является ультразвуковое сканирование [3–5]. Впервые в 1982 г. команда американских специалистов у повторнородящей филиппинки, имевшей в анамнезе одно кесарево сечение, в 25 нед гестации на фоне маточного кровотечения диагностировали предлежание плаценты с гипоэхогенной ретроплацентарной зоной. Такое сочетание особенностей плацентации было расценено ими как ультразвуковой признак врастания плаценты [6].
За прошедшие с тех пор годы менялись мнения о причинах патологической плацентации, эволюционировали классификации и диагностические алгоритмы, пополнился ряд ультразвуковых признаков PAS [7], совершенствовалось ультразвуковое оборудование, позволяющее с помощью современных технологий (стереоскопической визуализации кровотока, LumiFlow™), в частности, визуализировать вовлеченность стенки мочевого пузыря беременной в конгломерат тканей аномальной плацентации, то есть идентифицировать placenta percreta (PAS 3b) [8].
С целью повышения потенциала эхографии в диагностике PAS в 2015 г. был предложен Placenta Accreta Index (PAI). В группе высокого риска PAS, состоящей из беременных с предлежанием плаценты, ранее перенесших кесарево сечение, индекс рассчитывался с учетом количества ранее перенесенных кесаревых сечений в сочетании с совокупностью ряда ультразвуковых критериев (сосудистые лакуны, толщина миометрия в области нижнего маточного сегмента, локация плаценты относительно внутреннего зева, цветовые локусы), оцененных в баллах. По данным авторов методики, вероятность PAS может быть рассчитана с точностью от 83 до 96% [9].
Другая «сторона медали» проблемы оперированной ранее матки – это возможное формирование так называемого варианта эктопической беременности – рубцовой беременности (scar pregnancy) [10], диагностика которой потенциально возможна в ранние сроки, в первой половине I триместра [11].
Таким образом, становится понятным стремление современного профессионального сообщества к верификации аномальных типов плацентации в максимально ранние сроки беременности. Опыт идентификации подобных диагнозов невелик, при том, что подавляющее их большинство составляет группу «интраоперационных находок» [12–15].
Учитывая малый опыт ранней диагностики PAS, представляем собственный клинический опыт диагностики подобной аномальной плацентации.
Клиническое наблюдение
Повторнородящая Х., 38 лет. Настоящая беременность – пятая. Наступила спонтанно, без прегравидарной подготовки. В анамнезе двое оперативных родов (кесарево сечение в 2004 и 2007 гг.). Два выскабливания полости матки (1 артифициальный аборт, 1 неразвивающаяся беременность). В 2010 г. диагностирована миома матки 30 мм в диаметре (6-й тип по FIGO). Соматический анамнез не отягощен.
При настоящей беременности пациентка проходила скрининговое ультразвуковое исследование (УЗИ) в сроке 13+2 нед на оборудовании экспертного класса. При эхографии обнаружен 1 плод, размеры которого соответствуют гестационому сроку. Анатомических особенностей плода (врожденных пороков развития и ультразвуковых маркеров хромосомных аномалий) не выявлено. В дне матки визуализирован субсерозно-интерстициальный узел гомогенной эхоструктуры размерами 28 х 32 х 30 мм. Плацента расположена по передней стенке матки, нижним краем полностью перекрывает область внутреннего зева (рис. 1).
В 2D-режиме обнаружено фрагментарное отсутствие эхоизображения миометрия по центру передней стенки нижней трети тела матки. В этом месте визуализированы гипо-, анэхогенные структуры неправильной формы, в режиме ЦДК идентифицированные как сосудистые маточно-плацентарные лакуны (рис. 2). В режиме энергетического допплера подтверждено наличие в них медленного турбулентного кровотока (рис. 3). На основании данных УЗИ сформулировано заключение: беременность 13+2 нед. Предлежание плаценты, признаки приращения плаценты, PAS 1 (placenta adherent or creta).
С целью уточнения сформулированного заключения в сроке 13+3 нед проведена магнитно-резонансная томография (МРТ). Описано полное предлежание плаценты, МР-картина истончения и отсутствия миометрия по передней стенке матки в нижнем сегменте, свидетельствующее о плотном прикреплении плаценты в области послеоперационного рубца.
На основании полученных при УЗИ и МРТ данных, учитывая высокий риск инвалидизации и материнской смертности, а также настоятельное желание пациентки, было принято решение о прерывании беременности с предварительной эмболизацией маточных артерий (ЭМА) в условиях многопрофильного стационара.
В сроке 13+5 нед после проведения ЭМА с обеих сторон была выполнена лапароскопия: разделение спаек между большим сальником, маткой и мочевым пузырем, матка увеличена до 13–14 нед, серозный покров матки во всех отделах розового цвета, визуальных особенностей нижней трети передней стенки матки нет, в дне субсерозный узел на широком основании 30 х 30 мм. При лапароскопической ассистенции произведено выскабливание полости матки, «с трудом» удалены плацентарная ткань и фрагменты плода. Кровопотеря – 300 мл.
Особенности плацентации, описанные при УЗИ в сроке 13+2 нед, были верифицированы при последующем патологоанатомическом исследовании (рис. 4).
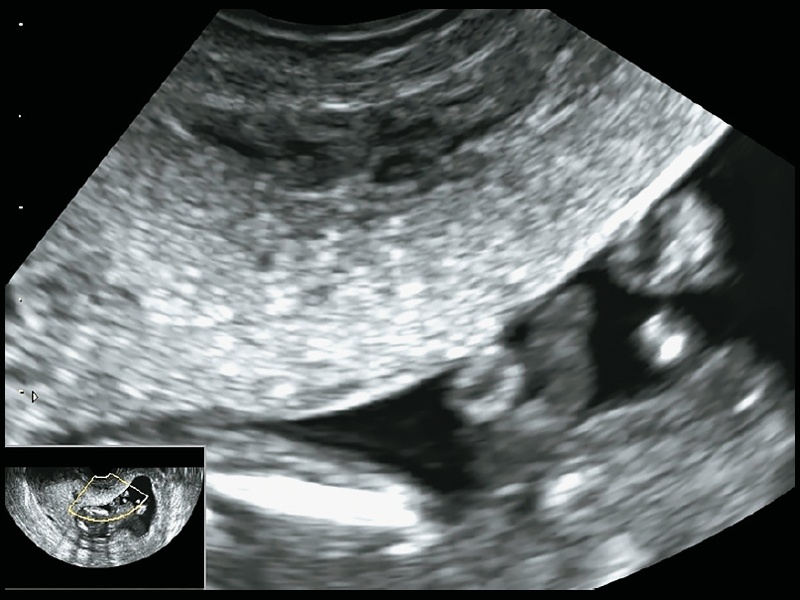
Рис. 1. Эхограмма плаценты, перекрывающей область внутреннего зева.
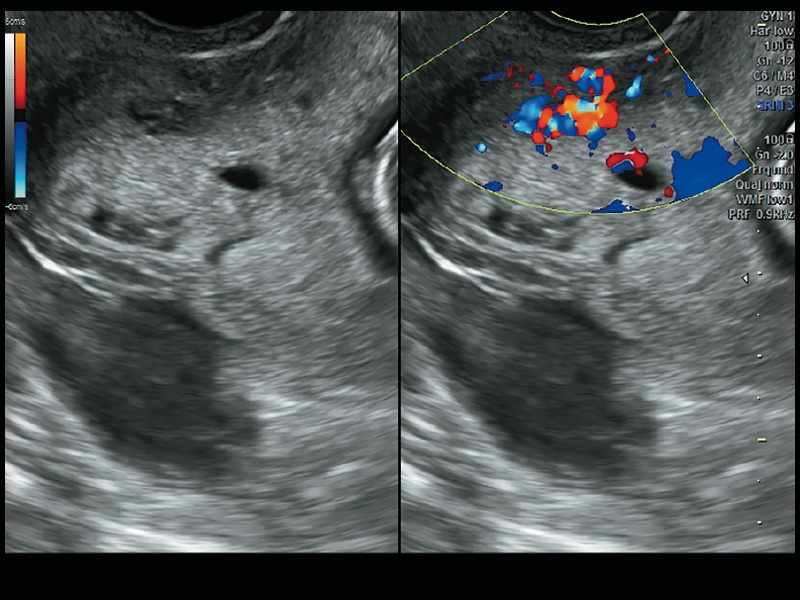
Рис. 2. Эхограмма, 2D-режим: фрагментарное отсутствие эхотени мометрия, гипо-, анэхогенные структуры неправильной формы. ЦДК-режим: сосудистые маточно-плацентарные лакуны.
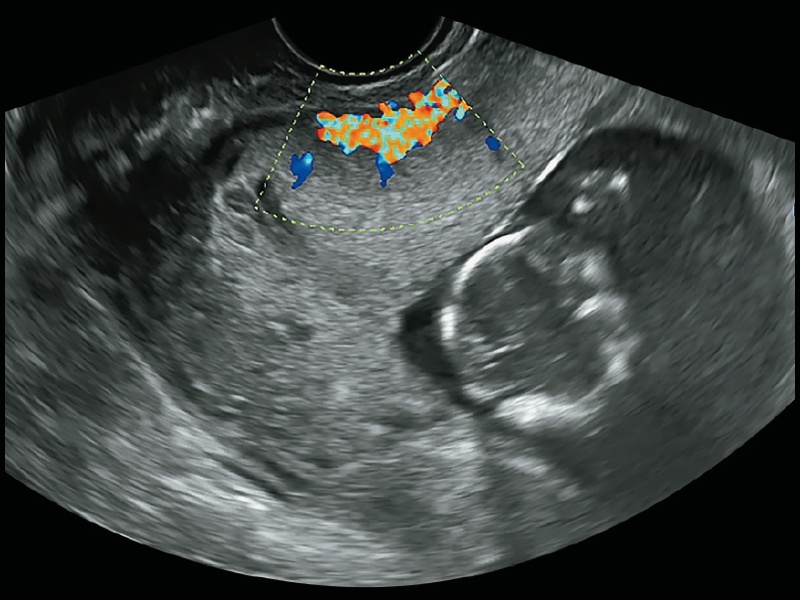
Рис. 3. Режим энергетического допплера: медленный турбулентный кровоток в лакунах.
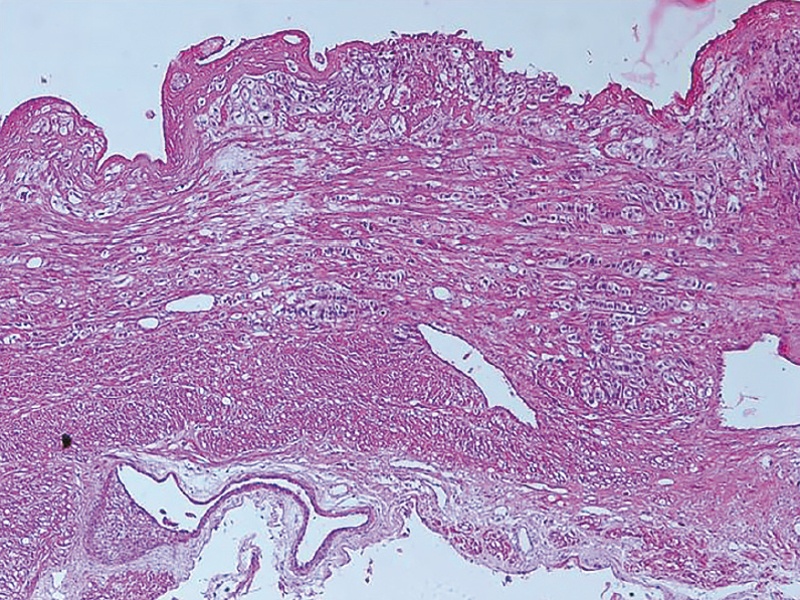
Рис. 4. Микрофотография, окраска гематоксилин-эозином, х50. Децидуальная ткань по всей толще мышечного слоя.
Обсуждение
Диагностика аномального прикрепления плаценты (PAS) на современном этапе развития акушерства не является труднорешаемой «сверхзадачей». Об этом свидетельствует бесконечно большое число публикаций об успешном ее решении. Известно, что и УЗИ в совокупности с МРТ обладает высоким диагностическим потенциалом в верификации PAS [9, 16–18]. Однако, как показали недавние зарубежные исследования, до родов PAS не диагностируется в 2/3 случаев, при том что в 1/3 случаев это происходит в специализированных многопрофильных стационарах [цит. по 19]. В то же время, по данным A. Eller и соавт., в 28% случаев пренатально сформулированный диагноз PAS не имел гистопатологического подтверждения [20]. Коллизия, кажущаяся сложность, парадоксальность данной ситуации, с нашей точки зрения, в следующем. Пренатальный диагноз PAS в известной мере субъективен и определяется опытом специалиста в выявлении данной патологии, который может быть ограничен редкостью ее встречаемости, отсутствием тренировочных программ, классом используемого оборудования [19].
В настоящее время остается актуальным, не получившим окончательного ответа ряд вопросов. Кому проводить УЗИ для выявления PAS? Достаточно ли безвыборочного скринингового исследования или необходим селективный ультразвуковой скрининг в группе женщин, имеющих в анамнезе кесарево сечение [21]? Когда проводить данное исследование? В сроки первого пренатального скрининга (11–13+6 нед), определенного Приказом Минздрава РФ №1130н от 20.10.2020? Или исходя из тесной связи между PAS и рубцовой беременностью (scar pregnancy), для которой требуется максимально ранняя диагностика в сроке 7–8 нед [10, 11], эхографию проводить в эти же сроки? Ответ на эти вопросы, по нашему мнению, следующий. Целенаправленным поиском PAS (в ранние сроки гестации, в частности) должен заниматься подготовленный специалист экспертного уровня, врач акушер-гинеколог, компетентный в вопросах ультразвуковой диагностики, эксплуатирую- щий высокоразрешающее современное оборудование, консультирующий специально сформированную когорту пациенток (беременных в сроке гестации 7–8 нед, имеющих в анамнезе указание о перенесенном ранее кесаревом сечении).
Однако пока дискуссия о путях оптимизации диагностики PAS продолжается, надеемся, что представленный нами случай диагностики аномального прикрепления плаценты в I триместре беременности пополнит копилку отечественного опыта в решении данной проблемы.
Литература
- Palacios-Jaraquemada J.M., D`Antonio F., Buca D. et al. Systematic review on near miss cases of placenta accrete spectrum disorders: correlation with invasion topography, prenatal imaging, and surgical outcome // J Matern Fetal Neonatal Med. 2019; 30: 1–8. DOI: 10.1080/ 14767058.2019.1570494
- Jauniaux E., Collins S., Burton G. Placenta accreta spectrum: pathophysiology and evidence-based anatomy for prenatal ultrasound imaging // Am J Obstet Gynecol. 2018; 218 (1): 75–87. DOI: 10.1016/j. ajog.2017.05.067
- Jauniaux E., Collins S.L., Jurkovic D., Burton G.J. Accreta placentation: a systematic review of prenatal ultrasound imaging and grading of villous invasiveness // Am J Obstet Gynecol. 2016; 215 (6): 712–721. DOI: 10.1016/j.ajog.2016.07.044
- Jauniaux E., Chantraine F., Silver R.M., Langhoff-Roos J. FIGO consensus guidelines on placenta accreta spectrum disorders: Epidemiology // Int J Gynecol Obstet. 2018; 140 (3): 265–273. DOI: 10.1002/ijgo.12407
- Jauniaux E., Bhide A. Prenatal ultrasound diagnosis and outcome of placenta previa accreta after cesarean delivery: a systematic review and meta-analysis // Am J Obstet Gynecol. 2017; 217 (1): 27–36. DOI:10.1016/j. ajog.2017.02.050
- Tabsh K.M., Brinkman C.R., King W. Ultrasound diagnosis of placenta increta // J Clin Ultrasound. 1982; 10 (6): 288–290. DOI: 10.1002/jcu.1870100610
- Волков А.Е., Рымашевский М.А., Андрусенко И.В. Placenta accreta spectrum. Актуальные вопросы диагностики // Медицинский вестник Юга России. 2022; 13 (4): 58–65. DOI: 10.21886/2219-8075-2022-13-4-58-65. https://doi.org/10.21886/2219-8075-2022-13-4-58-65
- Волков А.Е., Хлопонина А.В. Ультразвуковая диагностика глубокой инвазии плаценты (PAS 3b) // SonoAce Ultrasound. 2022; 34: 3–7.
- Rac M.W.F., Dashe J.S., Wells C.E. et al. Ultrasound predictors of placental invasion: the Placenta Accreta Index // Am J Obstet Gynecol. 2015; 212 (343): 1–7. DOI: 10.1016/j.ajog.2014.10.022
- Эсетов М.А., Эсетов А.М. Эхография в эмбриональном периоде. Беременность в рубце на матке. М.: Издательский дом Видар-М, 2020: 95–111.
- Эсетов М.А., Эсетов А.М. Зона имплантации как эхографический критерий идентификации типов рубцовой и истмической беременностей у женщин с рубцом на матке. Медицинский вестник Юга России. 2022;13 (2): 72–79. https://doi.org/10.21886/2219-8075-2022-13-2-72-79
- Choi G.D., Choi W.K., Lee H.S. et al. A case of spontaneous rupture of the uterus with placenta increta in early pregnancy // Korean J Obstet Gynecol. 1996; 39: 1359–1364.
- Wang Y.-L., Weng S.-S., Huang W.-C. First-trimester abortion complicated with placenta accreta: A systematic review // Taiwan J Obstet Gynec. 2019; 58 (1): 10–14. DOI: 10.1016/j.tjog.2018.11.032
- Son G., Kwon J., Cho H. et al. A case of placenta increta presenting as delayed postabortal intraperitoneal bleeding in the first trimester // J Korean Med Sci. 2007; 22: 932–935. DOI: 10.3346/jkms.2007.22.5.932
- Ящук А.Г., Фаткуллина Д.А., Даутова Л.А. и др. Редкие состояния в акушерстве // Акушерство и гинекология. 2022; 12: 195–200. DOI:10.18565/aig.2022.144
- D’Antonio E., Lacovella C., Bhide A. Prenatal identification of invasive placentation using ultrasound: systematic review and meta-analysis // Ultrasound Obstet Gynecol. 2013; 42 (5): 509–517. DOI: 10.1002/uog/13194
- Palacios-Jaraquemada J.M., Bruno C.H., Martin E. MRI in the diagnosis and surgical management of abnormal placentation // Acta Obstet Gynecol Scand. 2013; 92 (4): 392–397. DOI: 10.111.1600-0412.2012.01527.x
- Meng X., Xie L., Song W. Comparing the diagnostic value of ultrasound and magnetic resonance imaging for placenta accreta: a systematic review and meta-analysis // Ultrasound Med Biol. 2013; 39 (11): 1958–1965. DOI: 01g/10.1016/j.ultrasmedbio.2013.05.017
- Гус А.И., Бойкова Ю.В., Ярыгина Т.А., Яроцкая Е.Л. Современные подходы к пренатальной диагностике и скринингу врастания плаценты (обзор рекомендаций) // Акушерство и гинекология. 2020; 10: 5–12. DOI: https://dx.doi.org/10.18565/aig.2020.10.5-12
- Eller A., Porter T., Soisson P., Silver R. Optimal management strategies for placenta accreta. BJOG. 2009; 116 (5): 648–654. DOI: 10.1111/j/1471-0528.2008.02037.x
- Panaiotova J., Tokunaka M., Kraewska K., Nocolaides K.H. Screening for morbidly adherent placenta in early pregnancy // Ultrasound Obstet Gynecol. 2019; 53 (1): 101–106. DOI: 10.1002/uog.20104

УЗИ сканер Samsung W10
Аппарат экспертного/премиум класса поможет расширить возможности диагностики, благодаря интуитивно понятным алгоритмам обработки и точным инструментам анализа.
Публикации по теме
- Липолейомиома матки: опыт диагностики - Волков А.Е.
- Особенности визуальной картины при различных молекулярных подтипах рака молочной железы у молодых пациенток: клинические наблюдения - Васильченко С.А.
- Ультразвуковая диагностика аномального прикрепления плаценты в I триместре беременности - Андрусенко И.В.
- Ультразвуковая диагностика глубокой инвазии плаценты (PAS 3b) - Волков А.Е.
- Аномальная форма сосудистых сплетений боковых желудочков – новый ультразвуковой маркер открытых дефектов позвоночника плода в I триместре - Эсетов М.А.



